
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部白色沉淀,上层为无色溶液;
②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。
③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)根据以上实验现象可知,该白色固体中一定含有 ,(填化学式,下同)一定不含有 ,可能含有 。
(2)若要检验未确定的物质是否存在,请说明如何操作(包括现象和结论)。
_____________________________。
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.盐酸滴在石灰石上:CO32-+2H+=H2O+CO2↑
B.少量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O
C.NaOH溶液和NaHSO4溶液反应:HSO4-+OH-=SO42-+H2O
D.稀H2SO4滴在铜片上:Cu+2H+=Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:实验题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
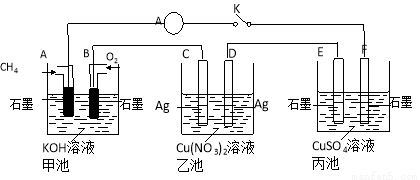
(1)甲池A电极的电极反应式为 。
(2)丙池中电解反应的方程式是 。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙醇(水) | 生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
下列关于分散系的说法,正确是
A. 稀硫酸、盐酸、空气和水等都是分散系
B. 一般可用丁达尔现象区分溶液和浊液
C. 按稳定性由弱到强的顺序排列的是溶液、胶体、浊液(以水为分散剂时)
D. 按照分散质和分散剂的状态(气、液、固态),它们之间可以有9种组合方式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中(文)化学试卷(解析版) 题型:选择题
医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的
A.碘元素 B.铁元素 C.钾元素 D.锌元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:
B.6~10min的平均反应速率:
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:填空题
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
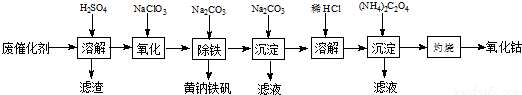
(1)溶【解析】
溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
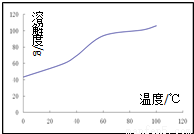
(5)溶【解析】
CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com