
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
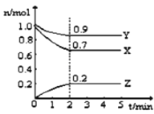
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
【答案】3X+Y![]() 2Z 1.2×10-3mol/(L·s ) 30% 放出 46 kJ 18.4 增大 不变 b
2Z 1.2×10-3mol/(L·s ) 30% 放出 46 kJ 18.4 增大 不变 b
【解析】
(1)从图像分析,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,当反应到达2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)= 3: 1: 2;
(2) 0~50s内的平均反应速率 v(NH3) =![]() ,因此v(N2)=
,因此v(N2)= ![]() ;250s时,生成了氨气0.4mol,反应的氢气的物质的量为0.6mol,计算H2的转化率;
;250s时,生成了氨气0.4mol,反应的氢气的物质的量为0.6mol,计算H2的转化率;
(3)已知N=N的键能为946kJ/mol,H-H 的键能为436kJ/mol,N-H 的键能为39 1kJ/mol,根据N2 + 3H2 ![]() 2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为
2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为![]() ×92 kJ =46 kJ,该反应为放热反应,反应达到(2)中的平衡状态时,生成氨气0.4mol,对应的能量变化为0.4mol ×46KJ = 18.4 kJ;
×92 kJ =46 kJ,该反应为放热反应,反应达到(2)中的平衡状态时,生成氨气0.4mol,对应的能量变化为0.4mol ×46KJ = 18.4 kJ;
(4)反应过程中,物质的总质量不变,但物质的量在不断减小,所以平均相对分子质量在不断增大;物质的总质量不变,容器的总体积不变,所以密度不变;
(5)根据影响化学反应速率因素进行分析作答。
(1)从图像可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,当反应到达2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)= 3: 1: 2,所以反应的化学方程式为:3X+Y![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y![]() 2Z;
2Z;
(2) 0~50s内的平均反应速率 v(NH3) =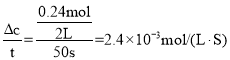 ,因此v(N2)=
,因此v(N2)= ![]() 1.2×10-3mol/(L·s );250s时,生成了氨气0.4mol,反应的氢气的物质的量为0.6mol,H2的转化率为
1.2×10-3mol/(L·s );250s时,生成了氨气0.4mol,反应的氢气的物质的量为0.6mol,H2的转化率为![]() ×100%=30%,故答案为:1.2×10-3mol/(L·s );30%;
×100%=30%,故答案为:1.2×10-3mol/(L·s );30%;
(3)已知N=N的键能为946kJ/mol,H-H 的键能为436kJ/mol,N-H 的键能为39 1kJ/mol,根据N2 + 3H2 ![]() 2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92kJ/mol,因此生成1molNH3过程中的热量变化为
2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92kJ/mol,因此生成1molNH3过程中的热量变化为![]() ×92 kJ =46 kJ,该反应为放热反应,反应达到(2)中的平衡状态时,生成氨气0.4mol,对应的能量变化为0.4mol ×46kJ = 18.4 kJ,故答案为:放出;46 kJ;18.4;
×92 kJ =46 kJ,该反应为放热反应,反应达到(2)中的平衡状态时,生成氨气0.4mol,对应的能量变化为0.4mol ×46kJ = 18.4 kJ,故答案为:放出;46 kJ;18.4;
(4)反应过程中,物质的总质量不变,但物质的量在不断减小,所以平均相对分子质量在不断增大;物质的总质量不变,容器的总体积不变,所以密度不变,故答案为:增大;不变;
(5) a.降低温度,反应速率减慢,错误;b.增大压强,反应速率加快,正确;c.恒容时充入He气,反应物的浓度不变,反应速率不变,错误;d.恒压时充入He气,反应物的浓度减小,反应速率减慢。错误;e.及时分离NH3,生成物的浓度减小,反应速率减慢,故答案为b。


科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: ;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
若有6 mol的HCl参加反应,则转移的电子总数为 ;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是

A.一定条件下X可发生氧化、取代、消去反应
B.1 mol Y最多能与4mol NaOH反应
C.X与足量H2反应后,每个产物分子中含有8个手性碳原子
D.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。25 ℃时,向0.100 mol·L1 Na2C2O4溶液中缓缓通入HCl气体(忽略溶液体积的变化)。下列指定溶液中微粒的物质的量浓度关系正确的是
A.0.100 mol·L1 Na2C2O4溶液中:c(C2O42)>c(HC2O4)>c(OH)>c(H+)
B.pH=7的溶液中:c(Cl-)=c(HC2O4)+2c(H2C2O4)
C.c(Cl-)=0.100 mol·L1溶液中:c(OH)c(H+)=c(H2C2O4)c(C2O42)
D.c(HC2O4)=c(C2O42)的酸性溶液中:c(Cl-)+c(HC2O4)<0.100 mol·L1+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是

A.装置A的优点是随开随用,随关随停
B.导管m的作用是平衡压强,观察是否堵塞
C.装置D中产生白色沉淀即可证明H2能还原FeCl3
D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
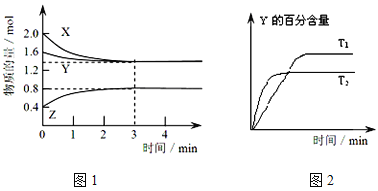
A.容器中发生的反应可表示为:X(g)+Y(g) ![]() Z(g)
Z(g)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.反应进行的前3 min内,用X表示的反应速率 v(Z)=0.4mol/(L·min)
D.反应达到平衡后,增大压强,Z的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
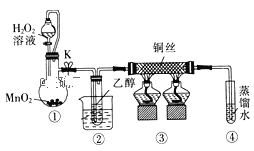
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
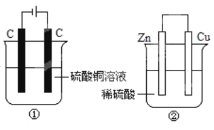
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com