
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
分析 (1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)①依据图表数据列式计算平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率的大小关系;
(3)依据盖斯定律进行计算,由$\frac{①-②+③×4}{2}$得出正确结论;
(4)H2C2O4和NaOH反应生成NaHC2O4,NaHC2O4溶液呈酸性说明溶液中电离大于水解,依此比较溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序;
(5)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,依此书写电极反应式.
解答 解:(1)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反应是气体体积减小的放热反应;
a.反应再恒压容器中进行,故容器中压强不变,不能说明反应达到平衡状态,故a错误;
b.H2的体积分数不变,说明反应达到平衡状态,故b正确;
c.平衡时各物质的浓度之比取决于物质的起始物质的量和转化率,故c(H2)=3c(CH3OH),不能说明反应达到平衡状态,故c错误;
d.密度=$\frac{总质量}{体积}$,总质量会变,体积会变,故容器中密度不变,说明反应达到平衡状态,故d正确;
e.2个C=O断裂是正反应,同时有6个H-H断裂也是正反应,故不能说明反应达到平衡状态,故e错误;
故答案为:bd;
(2)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.2×0.2}{0.3×0.8}$=0.17,
故答案为:0.17;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<$\frac{a}{b}$<1,
故答案为:<1;
③900℃时,当CO、H2O、CO2、H2均为1mol时,浓度商Qc=$\frac{0.5×0.5}{0.5×0.5}$=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,
故答案为:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
由$\frac{①-②+③×4}{2}$得:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=$\frac{-1275.6kJ/mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4}{2}$=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol;
(4)常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,H2C2O4和NaOH反应生成NaHC2O4,由于NaHC2O4溶液显酸性,故溶液中HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O.
点评 本题考查化学平衡的标志、平衡常数的计算及化学平衡移动原理、盖斯定律的计算应用、离子浓度大小的比较、电解池反应原理及电极反应式的书写,知识点较多,综合性很强,难度较大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:填空题
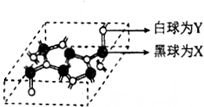 |  |
| 图(a) | 图(b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质相同 | |
| B. | 等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同 | |
| C. | 可以通过化学反应将淀粉转化为乙酸 | |
| D. | 同温下,等体积pH相同的NH4Cl溶液和HCl溶液中由水电离出的H+数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 HClO+H++Cl-.
HClO+H++Cl-. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
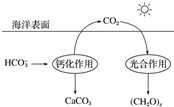


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物和氮氧化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com