
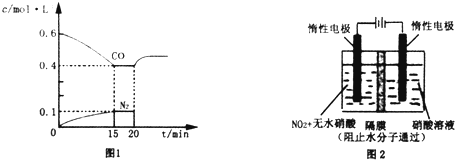
分析 (1)利用盖斯定律,将①×2-②×3,得热化学方程式;
(2)达到平衡时正逆反应速率相等,各物质的浓度不变,以此判断;
②计算反应达到平衡状态时各物质的浓度,结合平衡常数表达式计算;
③从反应开始到5min,生成了N20.05mol,则5min 内v(CO2)=$\frac{\frac{0.05mol×2}{2L}}{5min}$=0.01 mol•L-1•min-1;平衡常数表达式中CO的浓度是2次方,所以20min时再向容器中充入CO、N2各0.8mol,分母增加的幅度大,则Qc<K;
④平衡时一氧化碳的浓度增大,平衡向逆反应方向移动;
(3)利用NO2或N2O4可制备N2O5,N元素发生氧化反应,则N2O5在电解池的阳极区生成,根据电荷守恒可知有H+生成,氢离子可以自由的从左向右,所以是阳离子交换膜.
解答 解:(1)已知:
①N2(g)+3H2((g)?2NH3(g)△H1=-92.4kJ/mol;
②2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ/mol;
利用盖斯定律,将①×2-②×3,得2N2(g)+6H20(1)=4NH3(g)+302(g)△H=(-92.4kJ/mol)×2-(-571.6kJ/mol)×3=+1530.0kJ/mol,
故答案为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol;
(2)①a.化学平衡时应有v正(NO)=2v逆(N2),故错误;
b.气体总压不变,说明气体的物质的量不变,达平衡状态,故正确;
c.化学平衡时,c(CO2)和c(CO)可能相等,也可能不等,故错误;
d.混合气体的相对分子质量,说明气体的总物质的量不变,达平衡状态,故正确,
故答案为:bd;
②反应达到平衡状态时,c(CO)=0.4mol/L,C(N2)=0.1mol/L,C(CO2)=2C(N2)=0.2mol/L,C(NO)=0.7mol/L-(0.6-0.4)mol/L=0.5mol/L,K$\frac{0.2×0.{2}^{2}}{0.{4}^{2}×0.{5}^{2}}$L•mol-1=0.2 L•mol-1,故答案为:0.2 L•mol-1;
③从反应开始到5min,生成了N20.05mol,则5min 内v(CO2)=$\frac{\frac{0.05mol×2}{2L}}{5min}$=0.01 mol•L-1•min-1,平衡常数表达式中CO的浓度是2次方,所以20min时再向容器中充入CO、N2各0.8mol,分母增加的幅度大,则Qc<K,所以平衡向逆反应方向移动,故答案为:0.01 mol•L-1•min-1;向左;
④平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
a.缩小容器体积平衡向正反应方向移动,故错误;
b.增增加NO的浓度平衡向正反应方向移动,故错误;
c.升高温度平衡向逆反应方向移动,故正确;
d.加入催化剂不改变平衡移动,故错误;
故答案为:c;
(3)利用NO2或N2O4可制备N2O5,N元素发生氧化反应,则N2O5在电解池的阳极区生成,由图可知,阳极上是NO2失去电子,在HNO3条件下生成N2O5,根据电荷守恒可知有H+生成,电极反应式为:NO2-e-+HNO3=N2O5+H+,氢离子可以自由的从左向右,所以是阳离子交换膜,
故答案为:NO2-e-+HNO3=N2O5+H+;阳.
点评 本题综合考查化学反应速率的计算、化学平衡移动原理及化学平衡常数的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,难度较大,要注意利用化学平衡常数与浓度商的关系确定反应方向.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO32-、I-、CO32-、Cl-、SO42-、Fe2+、Na+、MnO4-,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B。
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C。
步骤三:往C溶液中通入足量Cl2,得黄褐色溶液D。
(1)该溶液中一定存在的离子是: 。
(2)该溶液中可能存在的阴离子是: 。
(3)步骤三中溶液变黄褐色是因为生成了某种物质,确认该物质的实验操作与现象是:取适量D溶液于试管中, 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是( )
A. 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B. 第ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则第ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C. Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
D. NaHSO4与NaHSO3溶液显酸性,则所有酸式盐溶液均显酸性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
关于酸、碱、盐的下列各种说法中,正确的是
A.化合物电离时,生成的阳离子有氢离子的是酸
B.化合物电离时,生成的阴离子有氢氧根离子的是碱
C.化合物电离时,生成金属阳离子和酸根离子的是盐
D.NH4Cl通电时能电离出NH4+和Cl?,所以NH4Cl是盐
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 采用长玻璃导管有导气兼冷凝的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
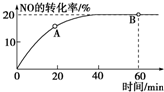 (1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.
(1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.氧化还原反应一定有氧元素参加 B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生 D.一定有电子转移(得失或偏移)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com