
| A. | 3:2 | B. | 2:5 | C. | 3:4 | D. | 4:3 |
分析 将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,生成的气体体积不同,盐酸不足,设碳酸钠溶液物质的量浓度为c1,盐酸的物质的量浓度为c2,依据方程式进行计算.
解答 解:将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,生成的气体体积不同,盐酸不足,设碳酸钠溶液物质的量浓度为c1,盐酸的物质的量浓度为c2,
盐酸滴到碳酸钠中发生两步反应,盐酸对第一步反应过量,对第二步反应不足:
Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,
c1 c2 c1 (c2-c1 ) (c2-c1 )
生成二氧化碳的物质的量(c2-c1);
碳酸钠滴到盐酸中,依据盐酸的量计算生成二氧化碳的体积:
Na2CO3+2HCl═2NaCl+CO2↑+H2O
c2 0.5c2
生成二氧化碳物质的量0.5c2,依据题意:(c2-c1):0.5c2=1:2,则c1:c2=3:4;
故选:C.
点评 本题考查了有关物质的量计算,明确碳酸钠与盐酸性质及发生反应实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
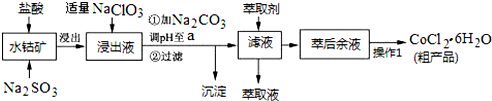
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
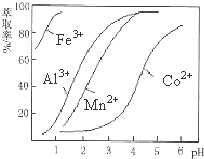
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
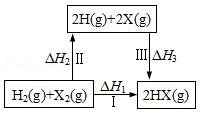
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO42-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Na+、Cl-、K+、SO42-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
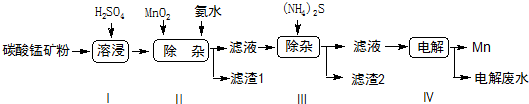
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com