
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-===![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.放电时正极附近溶液的酸性增强
【答案】D
【解析】
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,分析放电时,锌化合价升高,作负极,K2FeO4化合价降低,作正极;充电时,Fe(OH)3化合价升高,作阳极,Zn(OH)2化合价降低,作阴极。
3Zn(OH)2+2Fe(OH)3+4KOH,分析放电时,锌化合价升高,作负极,K2FeO4化合价降低,作正极;充电时,Fe(OH)3化合价升高,作阳极,Zn(OH)2化合价降低,作阴极。
A选项,锌化合价升高,为负极,放电时负极反应为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B选项,根据分析,Fe(OH)3化合价升高,作阳极,充电时阳极反应为Fe(OH)3-3e-+5OH-= FeO42-+4H2O,故B正确;
C选项,根据放电分析,3mol锌反应转移6mol电子,消耗2mol K2FeO4,因此放电时每转移3 mol电子,正极有1 mol K2FeO4被还原,故C正确;
D选项,放电时正极附近生成氢氧根离子,溶液碱性增强,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
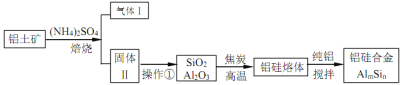
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
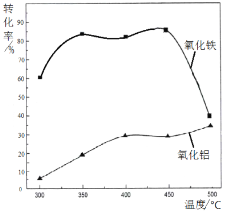
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了社会可持续发展,化工生产过程应尽量减少对环境的副作用。“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应,据此,由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() 2Cu(NO3)2
2Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是( )
A.Ka=![]() B.V=
B.V=![]() C.Ka=
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
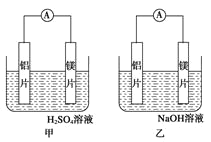
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com