
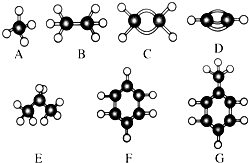
 A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是:| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
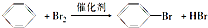 ,
,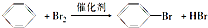 ;
; 主链有8个C原子,有两个甲基,名称为3,4-二甲基辛烷,2,6-二甲基-4-乙基-2-辛烯的结构简式是
主链有8个C原子,有两个甲基,名称为3,4-二甲基辛烷,2,6-二甲基-4-乙基-2-辛烯的结构简式是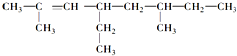 ,分子式为C12H24,1mol该有机物完全燃烧消耗的氧气的物质的量为(12+
,分子式为C12H24,1mol该有机物完全燃烧消耗的氧气的物质的量为(12+| 24 |
| 4 |
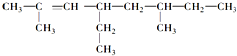 ;18.
;18.


科目:高中化学 来源: 题型:

| A、C的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中B的氢化物稳定性最好 |
| C、原子半径大小关系为:B>A |
| D、C的单质常温下为无色无味的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9 | B、10 | C、12 | D、15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
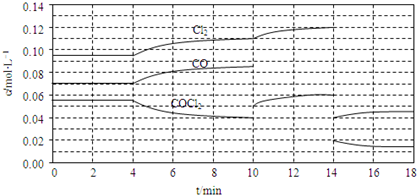
查看答案和解析>>
科目:高中化学 来源: 题型:
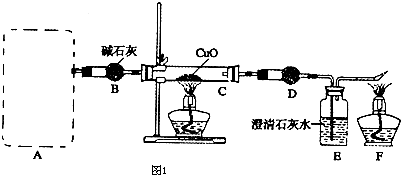
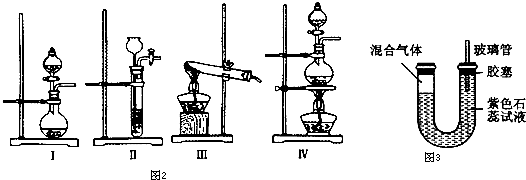
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能转变成热能、化学能转变成电能是能量转化的重要形式.
化学能转变成热能、化学能转变成电能是能量转化的重要形式.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能降低该反应的活化能 |
| B、逆反应的活化能大于正反应的活化能 |
| C、该反应为放热反应 |
| D、催化剂能改变该反应的焓变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com