
| 实验 编号 | T/K | 大理石 规格 | HNO3浓度 /(mol/L) | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (I)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究________________对该反应速率的影响; (Ⅲ)实验①和④探究________________对该反应速率的影响。 |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 298 | 细颗粒 | 2.00 | |
| ④ | 308K | 粗颗粒 | 2.00 |
科目:高中化学 来源:不详 题型:填空题
| 实验序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
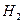 速率最大的是
速率最大的是| A.60°C,将0.1mol 镁粉加入到10mL 3mol·L-1的硝酸溶液中 |
| B.60°C,将0.1mol 镁粉加入到10mL 3mol ·L-1的盐酸溶液中 |
| C.60°C,将0.1mol 铁粉加入到10mL 3mol ·L-1的盐酸溶液中 |
| D.30°C,将0.1mol 镁粉加入到10mL 3mol ·L-1的硫酸溶液中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3 ,下列变化可以增大活化分子百分率使反应速率加快的是
2SO3 ,下列变化可以增大活化分子百分率使反应速率加快的是| A.①② | B.②③ | C.②④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入KHSO4固体 | B.不用铁片,改用铁粉 |
| C.滴加少量硫酸铜溶液 | D.加入KNO3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
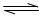 O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如下图所示。下列叙述正确的是 ( )
O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如下图所示。下列叙述正确的是 ( )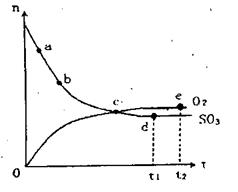
| A.点c处反应达到平衡 |
B.点d(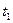 时刻)和e( 时刻)和e(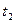 时刻)处n(SO2)一样 时刻)处n(SO2)一样 |
| C.点c的逆反应速率比点e大 |
| D.点b的正反应速率比点a大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活化分子间所发生的分子间的碰撞为有效碰撞 |
| B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大 |
| C.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| D.增大压强,活化分子数一定增加,化学反应速率一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com