
下列叙述正确的是( )
A.标准状况下,11.2 L NH3溶于1 L水,溶液中含有N原子的微粒总数为0.6NA
B.1.00 mol NaCl中,所有Na+的最外层电子总数约为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒.
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
下列说法错误的是
A.使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3)
B.0.1 mol·L-1的醋酸中加入水或加入冰醋酸均可使醋酸电离平衡向电离方向移动
C.等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大
D.等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+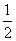 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+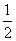 O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A.① B.④ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
改变反应条件使化学平衡向正反应方向移动,下列判断正确的是( )
A.生成物浓度一定增大 B.生成物的物质的量分数一定增大
C.反应物转化率一定提高 D.某生成物的产率可能提高
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:
CO2(g)+C(s) 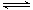 2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则
指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡______________,c(CO2)___ _____。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡__________________,c(CO)________
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量
(10分) (1)不移动 不变 (2)向逆反应方向移动 增大 (3)不移动 不变 (4)向正反应方向移动 增大(5)减少(6)不变
29、(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
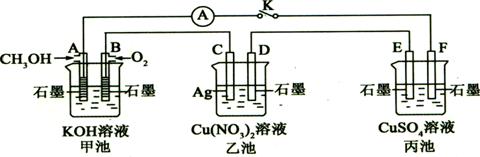
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为 。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体时,仰视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.① ③ ⑤ ⑥ B.① ② ⑤ ⑥ C.② ③ ④ ⑥ D.③ ④ ⑤ ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
超导材料为具有零电阻及反磁性物质,以Y2O3、BaCO3和CuO为原料.经研磨烧结可合成一种高温超导物质YBa2Cu3Ox现欲合成0.5mol此高温超导物,依化学计量比例,需取Y2O3.BaCO3和CuO的物质的量分别为(单位为mol)
A.0.50.0.50.0.50 B.0.25.1.0.1.5
C.0.50.1. 0.1. 5 D.1.0.0.25.0.17
查看答案和解析>>
科目:高中化学 来源: 题型:
面对能源与环境等问题,全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: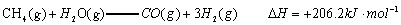
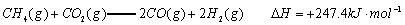
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。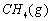 与
与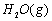 反应生成CO2(g)和
反应生成CO2(g)和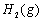 的热化学方程式为 。
的热化学方程式为 。
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
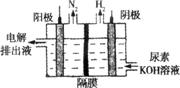 (3)
(3)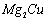 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,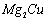 与
与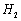 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则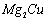 与
与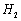 反应的化学
反应的化学
方程式为 。
 Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应:
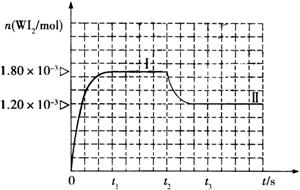
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: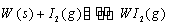 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的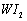 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象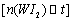 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
(4)该反应是 (填写“放热”或“吸
热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(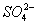 )>c(
)>c(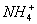 )>c(
)>c(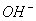 )=c(H+)
)=c(H+)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(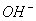 )>c(
)>c(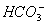 )>c(H+)
)>c(H+)
C.Na2CO3溶液:c(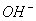 )-c(H+)=c(
)-c(H+)=c(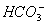 )+2c(H2CO3)
)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c(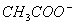 )+c(
)+c(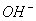 )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com