
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
分析 A.T1℃时活性炭的物质的量变化0.030mol,NO变化0.060mol,N2变化0.030mol,X的物质的量变化为0.030mol,可结合质量守恒判断;
B.计算各气体的平衡浓度,代入平衡常数表达式计算;
C.由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
D.加入固体,平衡不移动.
解答 解:A.T1℃时活性炭的物质的量变化0.030mol,NO变化0.060mol,N2变化0.030mol,X的物质的量变化为0.030mol,化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,故反应方程式为:C+2NO?N2+CO2,故A正确;
B.从表中数据可知T1℃时的平衡浓度c(NO)=$\frac{0.04mol}{1L}$=0.04mol/L,c(N2)=c(CO2)=$\frac{0.03mol}{1L}$=0.03mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.03×0.03}{0.0{4}^{2}}$=0.5625,故B错误;
C.由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化,故C错误;
D.加入固体,浓度不变,则平衡不移动,转化率不变,故D错误.
故选A.
点评 本题考查化学平衡计算、平衡移动等,为高频考点,旨在考查学生对数据的分析能力、计算能力,注意把握表中数据的分析,掌握平衡移动的影响,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始物质的量/mol | 4分钟后平衡时的物质的量/mol | 平衡时放出的热量/kJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4 mol•L-1•min-1 | |
| B. | 平衡时,放出的热量为:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
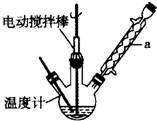 甲苯(
甲苯(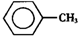 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(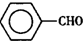 )、苯甲酸(
)、苯甲酸(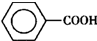 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com