
 完成下列各小题.
完成下列各小题. 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
;分析 (1)烷烃命名时,要选择最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
(2)烷烃中含有取代基乙基,则主链至少含有5个C原子,据此写出满足条件的烷烃的结构简式;
(3)①交点为C原子,交点之间的短线是化学键,利用H原子饱和碳的四价结构,据此书写分子式;
②根据篮烷的结构可知,其属于环烷烃,故不溶于水,且由于其相对分子质量比较大,故熔沸点比较高,不是气体,据此分析其性质;
③篮烷的氢原子有几种,其一氯代物就有几种,据此分析.
解答 解:(1)烷烃命名时,要选择最长的碳链为主链,则主链上有8个碳原子,从离支链近的一端给主链上碳原子进行编号,则在2号和6号碳原子上各有一个甲基,故名称为:2,6二甲基辛烷,故答案为:2,6二甲基辛烷;
(2)采用知识迁移的方法解答,该烷烃相当于甲烷中的氢原子被烃基取代,如果有乙基,主链上碳原子最少有5个,所以该烃相当于甲烷中的3个氢原子被乙基取代,故该烃的结构简式
故答案为 ;
;
(3)①由蓝烷的结构可知,分子中含有12个C原子、14个H原子,分子式为C12H14,故答案为:C12H14;
②根据篮烷的结构可知,其属于环烷烃.
a、烃类均不溶于水,故a不选;
b、烃类的密度均比水小,故b选;
c、由于篮烷属于环烷烃,故不能和溴水发生加成发生,故c选;
d、由于其相对分子质量比较大,故熔沸点比较高,在常温下不是气体,故d选.
故选bcd.
④该分子属于高度对称结构,有如图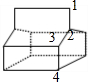 所示的4种H原子,故其一氯代物就有几种同分异构体,故答案为:4;
所示的4种H原子,故其一氯代物就有几种同分异构体,故答案为:4;
点评 本题考查有机物的结构、同分异构体等,难度中等,实际是键线式结构,注意对结构的仔细观察.


科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol -1 ) | 436 | 157 | 568 | 432 | 298[ |
| A. | H2(g)+F2(g)═2HF(g)△H=-25 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2(g)→2H(g)△H=+436 kJ•mol -1 | |
| D. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.15 mol•L-1•S-1 | B. | V(B)=0.3 mol•L-1•S-1 | ||
| C. | V(C)=0.4 mol•L-1•S-1 | D. | V(D)=0.45 mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2和1molH2 | B. | 5.6LN2(标准状况下)和11gCO2 | ||
| C. | 224mLH2(标准状况下)和0.1molN2 | D. | 9gH2O和0.5molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6 ⑧
⑧
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液、FeCl3溶液 | B. | 溴水、KMnO4溶液 | ||
| C. | NaOH溶液、FeCl3溶液 | D. | 溴水、Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com