
| A. | 混合气体的颜色不再变化 | B. | 混合气体的压强不再变化 | ||
| C. | 反应速率v(H2)=$\frac{1}{2}$v(HI) | D. | c(H2):c(I2):c(HI)=1:1:2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.只有碘有颜色,当混合气体的颜色不再变化时,正逆反应速率相等,反应达到平衡状态,故A正确;
B.反应前后气体的物质的量之和不变,则反应前后混合气体的压强不变,不能根据压强判断平衡状态,故B错误;
C.反应速率v(H2)=$\frac{1}{2}$v(HI),没有确定正逆反应方向,不能判断是否达到平衡状态,故C错误;
D.c(H2):c(I2):c(HI)=1:1:2时,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,侧重考查学生分析判断能力,只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
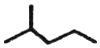 ②甲苯 ③ClCH=CHCl ④
②甲苯 ③ClCH=CHCl ④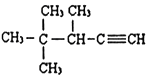
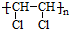
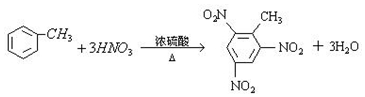 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 氧化铁是金属氧化物 | 可做染料 |
| B | 氢氧化铝具有弱碱性 | 可用于制胃酸中和剂 |
| C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
| D | 硬铝是合金 | 其熔点比金属铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、CH2═CH2、CH2═CHCH═CH2均属于饱和链烃 | |
| B. | CH3CH2CH3、CH3CH═CH2、CH3CH═CHCH2CH═CH3均属于脂肪链烃 | |
| C. | CH3CH3、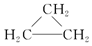 、C18H38均属于饱和烃 、C18H38均属于饱和烃 | |
| D. | 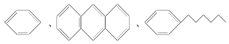 均属于芳香烃 均属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 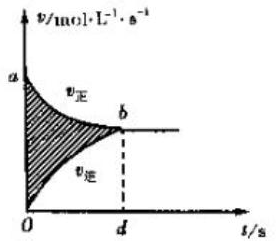 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 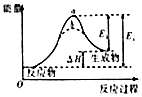 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 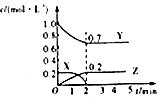 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 凡pH<7的雨水就可看作“酸雨” | |
| B. | 燃烧不一定要有氧气的参加,但燃烧一定是氧化还原反应 | |
| C. | 用NaClO溶液代替Cl2作为漂白剂是由于它难分解且在空气中可转化为HClO | |
| D. | 玻璃是氧化物,成分可表示为Na2OCaO•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
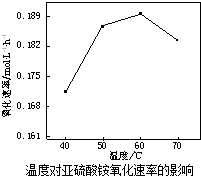 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: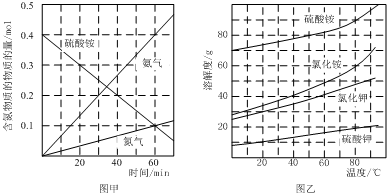
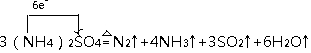 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com