

分析 由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体.
(1)只有MnO2不与硫酸反应;
(2)结合电子、电荷守恒分析;
(3)蒸发所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中有NaClO3和NaCl生成;
(4)由于物质的量浓度的计算公式是c=$\frac{n}{V}$,操作过程中如果使n值偏大则c偏大,否则偏小;如果使v偏大则c偏小,否则偏大;
(5)根据质量守恒和化学方程式计算,CO2的物质的量为0.01mol,则MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为 $\frac{2.84g}{71g/mol}$=0.04mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.05mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.02mol.
解答 解:由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体.
(1)只有MnO2不与硫酸反应,则MnO和MnCO3转化为可溶性物质,
故答案为:MnO和MnCO3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,
故答案为:5Mn2+;2;4H2O;5;1;8H+;
(3)第③属于蒸发,所以所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl,
故答案为:蒸发皿;玻璃棒;NaCl;
(4)A.量筒使用错误,使用量同时不需要洗涤量筒,若洗涤量筒并将洗涤液倒入烧杯,相当多量取硫酸,n值偏高,c偏高,故A错误;
B.定容时俯视液面导致液体的体积偏小,所配制溶液的物质的量浓度偏高,故B错误;
C.用量筒量取浓硫酸时,读数时俯视,导致浓硫酸液体的体积偏小,n值偏小,c偏低,故C正确;
D.容量瓶水洗未干燥,对溶质的物质的量和溶液的体积无影响,所以对配制溶液的物质的量浓度无影响,故D错误;
故选C;
(5)由题意知样品中的MnO和MnCO3质量为12.69g-8.7 g=3.99g.由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为$\frac{2.84g}{71g/mol}$=0.04mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.05mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.02mol,
故答案为:0.02.
点评 本题考查物质制备实验方案的设计,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
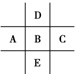 图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )
图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )| A. | P | B. | S | C. | Cl | D. | Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4和C3H6的混合物的质量为ag,所含碳氢键数目为aNA/7 | |
| B. | 标准状况下,2.24L 2H35Cl中所含中子数为1.8NA | |
| C. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中$HC{{O}_{3}}^{-}$和$C{{O}_{3}}^{2-}$的离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC5H12O中含有的共价键数目为17NA | |
| B. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3.5NA | |
| C. | 在铁和氯气的反应中,1mol铁失去的电子数为2NA | |
| D. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物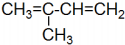 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是化合价变化 | |
| B. | 具有氧化性的物质在反应中一定做氧化剂 | |
| C. | 氧化剂氧化其他物质时,本身被还原 | |
| D. | 还原剂在反应中本身被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1KNO3溶液中滴加稀盐酸使溶液的pH=5,此时混合液中c(K+)<c(NO3-) | |
| B. | 25℃时,0.1 mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1 mol•L-1NH4Cl溶液中c(Cl-)=c(NH4+) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加Al放出H2的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | 由水电离出的c(OH-)=1.0×10-2 mol•L-1的溶液:Cl-、CH3COO-、K+、AlO2- | |
| C. | 水电离出的c(H+)=$\sqrt{Kw}$的溶液中:Na+、SO42-、CO32-、K+ | |
| D. | $\frac{c(OH-)}{c(H+)}$=1012的溶液中,NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com