
| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
分析 A.青石棉属于硅酸盐,多数不易燃,也不溶于水;
B.青石棉中铁元素的化合价由+2价和+3价两种;
C.硝酸能将二价铁离子氧化为三价铁离子;
D.青石棉能与氢氟酸反应生成四氟化硅.
解答 解:A.青石棉属于硅酸盐,不易燃,也不溶于水,故A错误;
B.青石棉中铁元素的化合价由+2价和+3价两种,根据原子守恒和化合价不变的思想,化学组成用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O,故B错误;
C.6L 3mol/L HNO3溶液中硝酸的物质的量为18mol,青石棉用稀硝酸溶液处理时,亚铁离子被氧化为铁离子,硝酸被还原为一氧化氮,产物为NaNO3、Fe(NO3)3、NO、H2O、SiO2,1mol该物质能和18molHNO3反应,故C正确;
D.5.5L 2mol/L HF溶液中HF的物质的量为11mol,1mol青石棉能与34mol氢氟酸反应生成四氟化硅,故D错误;
故选C.
点评 本题主要考查学生无机非金属材料的有关知识,注意硅酸盐用氧化物表示的一般顺序,题目难度不大.


科目:高中化学 来源: 题型:解答题

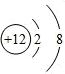 ,A的电子式为
,A的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
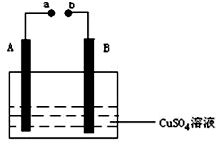 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol•L-1 | B. | 2.5mol•L-1? | C. | 2.1mol•L-1 | D. | 1.27mol•L-1? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、SO42- | B. | Na+、H+、Cl-、HCO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | NH4+、OH-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ | |
| B. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si均能一步实现 | |
| C. | 33gCH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol | |
| D. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,可能含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
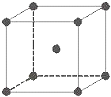 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com