
| 4.6g |
| 5g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| Cl2,光照 |
| ① |
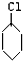
| NaOH、乙醇、△ |
| ② |
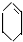
| 溴的CCl4溶液 |
| ③ |
| ④ |
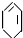
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由已知信息可得NA=
| ||
B、W g该原子的物质的量一定是
| ||
C、W g该原子中含有
| ||
| D、该元素的摩尔质量是aNA g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、分别加水稀释10倍,四种溶液的pH:②>①>④>③ |
| B、将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 |
| C、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| D、将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4-8e-+8OH-=CO2+6H2O |
| B、O2+4H++4e-=2H2O |
| C、CH4+10OH--8e-=C32-+7H2O |
| D、O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能:B<Be<Mg<Na |
| B、元素的电负性:O>N>S>P |
| C、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
| D、原子半径:Be<B<C<N |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滴有KSCN的FeCl2溶液变红色Cl2具有还原性 |
| B、滴有酚酞的NaOH溶液褪色 Cl2具有酸性 |
| C、石蕊溶液先变为红色后褪色Cl2具有漂白性 |
| D、KI淀粉溶液中变蓝色 Cl2具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com