
| A. | SO2 0.4mol/L | B. | SO2 0.25mol/L | ||
| C. | SO2 和SO3均为0.15mol/L | D. | O2 0.2mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:该题2SO2(g)+O2(g)?2SO3(g)是一个可逆反应.假设SO2(g)和O2(g)全部转化为SO3(g).
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0 0 0.4mol?L-1
假设SO3(g)全部转化为SO2(g)和O2(g)
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0.4mol?L-1 0.2mol?L-1 0
该反应是一个可逆反应,无论向正反应方向进行还是向逆反应方向进行,实际不可能100%转化.
综上情况可知:0<c(SO2)<0.4mol?L-1 ;0<c(O2)<0.2mol?L-1 ;0<c(SO3)<0.4mol?L-1 .
A、SO2为0.4mol?L-1 不在范围内,不符合条件,故A不选;
B、SO2为0.25mol?L-1在范围内,符合条件,故B选;
C、0<c(SO2)<0.4mol/L,0<n(SO3)<0.4mol?L-1 ,但是SO2 和SO3不能都为0.15mol/L,反应物和产物不能同时减少,故C不选;
D、0<n(O2)<0.2mol?L-1 不在范围内,不符合条件,故D不选;
故选B.
点评 理解什么是可逆反应,其特点反应物不能完全转化为生成物,生成物也不能完全转化为反应物,是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 硬度由大到小:金刚石>晶体硅>碳化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的碱性保持不变 | |
| D. | 电池工作时,当有3mol电子通过外电路时,消耗16.8LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol H2SO4 | B. | 0.4 mol H2O2 | C. | 0.6mol HNO3 | D. | 0.8 mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
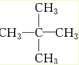 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 预计能产生的现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
有关反应原理说法错误的是
A.碳酸钙与盐酸反应过程中,再增加CaCO3固体的量,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率
B.增大反应体系的压强,反应速率不一定增大
C.由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大
D.对于2SO2(g)+O2(g)  2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志
2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com