
| A�� | 20mL 3mol•L-1Na2S2O3����Һ | B�� | 20mL 2mol•L-1Na2S2O3����Һ | ||
| C�� | 10mL 4mol•L-1Na2S2O3����Һ | D�� | 10mL 2mol•L-1Na2S2O3����Һ |
���� ��ѧ��Ӧ�У���Ӧ��Ũ��Խ��λ����������ĿԽ�࣬��Ӧ����Խ������Һ����ˮϡ�͵�50mL����ɼ���Na2S2O3�����ʵ��������ʵ���Խ�࣬Ũ��Խ��
��� �⣺����ˮϡ�͵�50mL��
A��n��Na2S2O3��=0.02L��3mol/L=0.06mol��
B��n��Na2S2O3��=0.02L��2mol/L=0.04mol��
C��n��Na2S2O3��=0.01L��4mol/L=0.04mol��
D��n��Na2S2O3��=0.01L��2mol/L=0.02mol��
���ʵ���������A����AŨ�����Ӧ�������
��ѡA��
���� ���⿼�黯ѧ��Ӧ���ʵ�Ӱ�����أ�Ϊ��Ƶ���㣬ע��ӱȽ�Ũ�ȵĽǶȽ����⣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaH������+1�� | |
| B�� | NaH�������Ӱ뾶������Ӱ뾶С | |
| C�� | NaH�������ӵĵ��Ӳ��Ų��뺤ԭ����ͬ | |
| D�� | NaH�������ӿɱ���ԭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ʵ���/mol ʱ�� | n��N2H4�� | N��NO2�� | N��N2�� |
| ��ʼ | 2.0 | 3.0 | 0 |
| ��2min | 1.5 | a | 0.75 |
| ��4min | 1.2 | b | 1.2 |
| ��6min | 1.0 | c | 1.5 |
| ��7min | 1.0 | c | 1.5 |
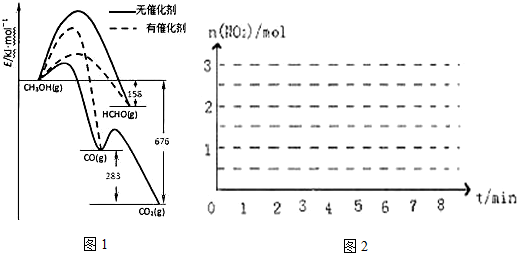
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ͻ����������ɷֽ��������ʲ���ȫ��ͬ | |
| B�� | ��ҵ�Ͻ���Mg��Al�����õ�����ڵ��Ȼ����Ƶõ� | |
| C�� | ��ɫ������ͭ���ջ���ש��ɫ | |
| D�� | ��������ͭ��[Cu2��OH��2CO3]��ͭ�����������н��ݣ���ȥͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ������Ϊ44g | B�� | ����Ϊ88g/mol | ||
| C�� | ��4mol��ԭ�� | D�� | ������Ϊ6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
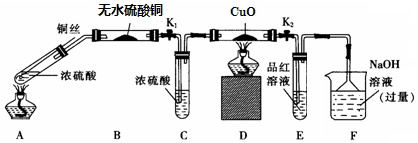
| ����/mol•L-1 | ��ɫ���ʳ��ֵ��¶�/�� | ��ɫ������ʧ���¶�/�� |
| 14 | Cu Ƭ�������������� | |
| 15 | Լ150 | Լ236 |
| 16 | Լ140 | Լ250 |
| 18 | Լ120 | ����ʧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2����ˮ����O2��Na2O2+H2O�T2Na++2OH-+O2�� | |
| B�� | ����CuSO4��Һ��Ӧ��2Na+Cu2+�TCu��+2Na+ | |
| C�� | Ca��HCO3��2��Һ������NaOH��Һ��Ӧ��HCO3-+Ca2++OH-�TCaCO3��+H2O | |
| D�� | Ba��OH��2��Һ��ϡH2SO4��Ӧ��Ba2++OH-+H++SO42-�TBaSO4��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com