
| A. | 煤干馏 | B. | 石油的减压分馏 | C. | 石油裂解 | D. | 煤液化 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
解答 解:A.煤的干馏是指将煤隔绝空气加强热使之分解的过程,属于化学变化,故A错误;
B.石油的减压分馏没有新物质生成,属于物理变化,故B正确;
C.石油裂解是大分子分解生成小分子,是化学变化,故C错误;
D.煤液化,是把固体炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,有新物质生成,属于化学变化,故D错误.
故选B.
点评 本题考查化学变化,注意化学变化的实质是有新物质生成,解答本题时须从概念入手,分析各选项是否有生成新物质,即可解题,本题难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | a-b=n-m | C. | c+d=m+n | D. | b-d=n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥⑧ | B. | ④⑤ | C. | ①②③ | D. | ⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
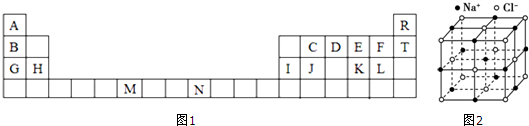
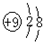 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
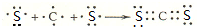 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com