
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,故答案为:
,故答案为: ;
;
| ||
| ||


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、1000 ml |
| B、500 ml |
| C、100 ml |
| D、1500 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
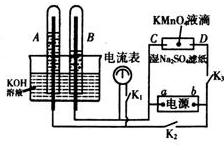 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com