
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1 mol |
| B、3 mol |
| C、5 mol |
| D、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为
工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应必然伴随发生能量变化,其能量变化主要是由化学键变化引起的 |
| B、化学反应中能量变化的大小与反应物的质量多少无关 |
| C、101kPa下,1mol的纯物质完全燃烧生成稳定的氧化物时的反应热叫燃烧热 |
| D、酸碱稀溶液中和生成1mol水时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4和C2H6 |
| B、C2H2和C3H8 |
| C、C2H6和C3H8 |
| D、C2H6和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | ||
| B、分子式为C4H7ClO2可与NaHCO3产生CO2,可能结构有3种 | ||
C、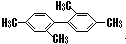 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | ||
D、用
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物所有原子一定在同一平面 |
| B、该有机物属于苯的同系物 |
| C、该有机物分子中含有21个碳原子 |
| D、该有机物一氯代物只有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com