
【题目】NH4Al(SO4)2在食品、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是____________________(用离子方程式表示)。
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)_____0.1mol/LNH4HSO4溶液中c(NH4+)(填“大于”、“等于”或“小于”)。
(3)下图是0.1mol/L 电解质溶液的pH 随温度变化的图像。

①其中符合0.1mol/LNH4Al(SO4)2溶液的是________(填字母)。导致溶液pH随温度变化的原因是_____________________________。
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+) -3c(Al3+)=_____mol/L。
(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH 溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:
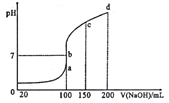
①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=_______,试分析图中a、b、c、d四点,水的电离程度最大的是______________________。
②在b点,溶液中各离子浓度由大到小的顺序是_______________。
③b-c段随着NaOH的加入,溶液中c(NH3·H2O)/c(OH-)的值_____(填“增大”、“减小”或 “不变”)。
【答案】 Al3++3H2O![]() A(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低 10-3或(10-3-10-11) 5 a c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+) 减小
A(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低 10-3或(10-3-10-11) 5 a c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+) 减小
【解析】本题主要考查有关盐类水解及中和反应的判断及计算。
(1)NH4Al(SO4)2可做净水剂,其理由是铝离子水解生成的氢氧化铝胶体能吸附除去水中的悬浮杂质,Al3++3H2O![]() A(OH)3(胶体)+3H+。
A(OH)3(胶体)+3H+。
(2) NH4HSO4溶液中大量H+抑制NH4+水解,所以相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)小于0.1mol/LNH4HSO4溶液中c(NH4+)。
(3)①其中符合0.1mol/LNH4Al(SO4)2溶液的是I。导致溶液pH随温度变化的原因是升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低。
②溶液中电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+ c(H+),由此可得2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)-c(OH-)=10-3或(10-3-10-11) mol/L。
(4)①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时,c(Al3+ )< 10-6mol/L,c(OH-)>( 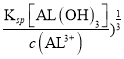 =10-9mol/L,溶液的pH=5。
=10-9mol/L,溶液的pH=5。
依次发生反应:Al3++3OH-![]() Al(OH)3↓ 和
Al(OH)3↓ 和![]() +OH-
+OH-![]() NH3·H2O ,图中b点时溶液中存在
NH3·H2O ,图中b点时溶液中存在![]() 和NH3·H2O,a点
和NH3·H2O,a点![]() 水解使溶液呈酸性,b、c、d 点含有的NH3·H2O越来越多,盐类水解促进水的电离,酸、碱抑制水的电离,因此, a、b、c、d四点,水的电离程度最大的是a。
水解使溶液呈酸性,b、c、d 点含有的NH3·H2O越来越多,盐类水解促进水的电离,酸、碱抑制水的电离,因此, a、b、c、d四点,水的电离程度最大的是a。
②在b点,溶液中存在Na2SO4、(NH4)2SO4、NH3·H2O,各离子浓度由大到小的顺序是c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+)。
③b-c段随着NaOH的加入,c(NH3·H2O)越来越大,电离程度越来越小,所以溶液中c(NH3·H2O)/c(OH-)的值减小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高温下可将煤转化为水煤气,水煤气可作为气体燃料,有关热化学方程式如下:
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ/mol
下列说法正确的是
A. 煤不属于化石燃料
B. 等质量的CO和H2完全燃烧时,前者放热多
C. 水煤气作为气体燃料,比煤直接燃烧污染小
D. 由反应③可以确定H2的燃烧热为241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蛋白质的叙述中,不正确的是
A. 蛋白质水解的最终产物为氨基酸
B. 酒精消毒的原理是让细菌蛋白质变性死亡
C. 向蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,再加入水沉淀不溶解
D. 浓硝酸溅在皮肤上,使皮肤呈黄色,是由于浓硝酸和蛋白质发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极都为情性电极。测得同温同压下,气体甲与气体乙的体比约为1: 2,以下说法正确的是
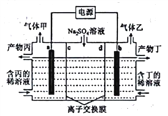
A. a极与电源的负极相连 B. 离子交换膜d为阴离子交换膜
C. 产物丙为硫酸溶液 D. 每转移0.2mol e- 则产生1.12L气体乙(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(P)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
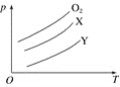
A. C2H4、CH4 B. CO2、Cl2
C. SO2、CO2 D. CH4、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中二氧化碳含量的持续增加,会产生温室效应,一种处理二氧化碳的重要方法是将二氧化碳还原,![]() ,下列说法(NA代表阿伏加德罗常数)正确的是
,下列说法(NA代表阿伏加德罗常数)正确的是
A. 2.24LCO2含有双键的数目为0.2NA
B. 1molCO2和2molH2充分反应生成CH4分子数为0.5NA
C. 通常状况下,0.1molCH4中含有的电子数为NA
D. 生成18gH2O转移电子数为8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com