
【题目】已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2__________________,XZ2__________________。
(3)用电子式表示Y2Z的形成过程:____________________________。
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):(SiHCl3相对分子质量为:135.5)
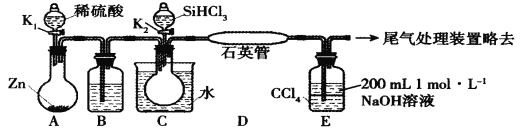
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g·mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)装置C中的烧瓶用水浴加热的优点为_____________________。
(2)装置D中发生反应的化学方程式为_____________________。
(3)装置E的作用为___________________。
(4)相关实验步骤如下,其合理顺序为_______________ (填序号)。
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1; ④关闭K2; ⑤加热装置D至1357 K。
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.1 mol·L-1盐酸滴定,达到滴定终点时,消耗盐酸20.00 mL。达到滴定终点的现象是____________。SiHCl3的利用率为__________%(保留两位小数)。
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____________。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
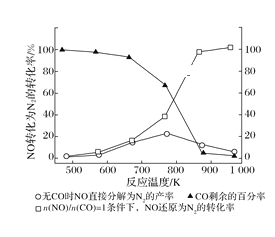
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
活性炭 | NO | E | F | |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①若T1<T2,则该反应的△H _________ 0(填“>”“<”或“=”)。
②上述反应T1℃时达到化学平衡后再通入0.10molNO气体,则达到新化学平衡时NO的总转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A的产量可以用来衡量一个国家石油化工发展水平。下图是由A为原料生产B的转化关系图,B是一种有香味的液体。

(1)将A通入溴水中,观察到的实验现象是__________,A分子中的官能团是______。
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_____________________。
(3)写出乙醇的一种用途____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
T | M层上的电子数是其原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下,单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 元素的最高正化合价是+7 |
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.钢铁发生电化学腐蚀时,正极上发生的反应为 Fe-2e-=Fe2+
B.用惰性电极分别电解熔融的NaCl和饱和食盐水时,阳极的电极反应式均为:2Cl- -2e-=Cl2↑
C.铜锌原电池工作时,若有13 克锌被溶解,外电路就有0.2 mol电子通过
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。已知 8.0 g CH4完全燃烧生成液态水放出445.15 kJ热量,则其热化学方程式为_____。
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
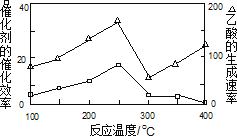
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_____。
③CH4 还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为 N2和O2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为_____。
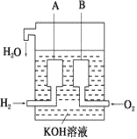
(3)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____。
若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
下图所示是硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
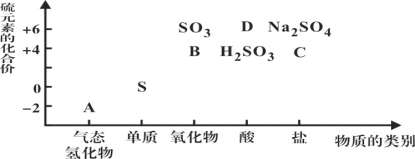
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊溶液的现象是__________________________;用一个化学方程式说明B具有还原性_____________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为__________(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)将A与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为_____。
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________________________,反应中D显示酸性和______________。
Ⅱ.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?
请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸使木条变黑__________
②热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。请回答下列问题:
配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com