
| A. | H2Te>H2Se>H2S>H2O | B. | KCl>NaCl>LiCl>HCl | ||
| C. | Sr>Ba>Ca>Be | D. | 金刚石>SiC>晶体硅 |
分析 A、水中存在氢键,所以熔点异常的高;
B、离子电荷相同,自上而下碱金属离子半径减小,故离子键强度LiCl>NaCl>KCl>RbCl;
C、同主族元素从上往下,电子层数增多,金属键减弱;
D、原子晶体原子半径越小,共价键越强熔点越高.
解答 解:A、水中存在氢键,所以熔点异常的高,所以熔点由高到低的顺序排列的是:H2O>H2Te>H2Se>H2S,故A错误;
B、离子电荷相同,自上而下碱金属离子半径减小,故离子键强度LiCl>NaCl>KCl,所以熔点由高到低的顺序排列为:LiCl>NaCl>KCl>HCl,故B错误;
C、同主族元素从上往下,电子层数增多,金属键减弱,所以熔点由高到低的顺序排列的是Be>Ca>Ba>Sr,故C错误;
D、原子晶体原子半径越小,共价键越强熔点越高,原子半径Si>C,所以熔点由高到低的顺序排列的是金刚石>SiC>晶体硅,故D正确;
故选D.
点评 本题考查晶体熔沸点高低判断,明确晶体类型及影响晶体熔沸点高低的因素是解本题关键,知道离子晶体中晶格能的影响因素,熟练掌握碱土金属族、卤族中性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:填空题
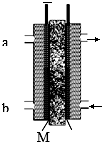 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
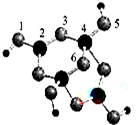 回答以下问题:
回答以下问题:| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
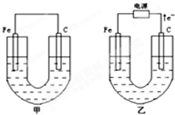 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜分别溶于盐酸和醋酸 | |
| B. | 石灰石分别与硝酸和盐酸反应 | |
| C. | 硫酸铜溶液分别与氯化钡和氢氧化钡溶液反应 | |
| D. | 稀硫酸分别与碳酸钠、碳酸氢钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
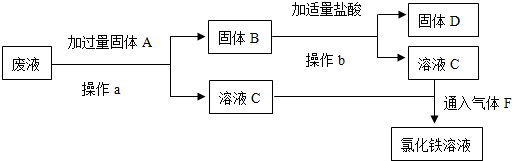
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 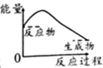 | C. |  | D. | 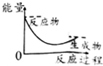 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
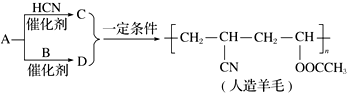
| A. | 合成人造羊毛的反应属于缩聚反应 | B. | A生成C的反应属于加成反应 | ||
| C. | A生成D的反应属于取代反应 | D. | 烃A的结构简式为CH2═CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com