
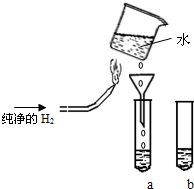
 某实验探究小组进行氢气在空气中燃烧的实验探究,装置如图所示(固定装置略去),在试管a和b中分别装入少量下表溶液进行实验:
某实验探究小组进行氢气在空气中燃烧的实验探究,装置如图所示(固定装置略去),在试管a和b中分别装入少量下表溶液进行实验:| 实验 | 试管a | 试管b(作对比用) | 试管a中实验现象 |
| ① | KI-淀粉溶液 | KI-淀粉溶液 | 溶液变蓝色 |
| ② | 酸性高锰酸钾稀溶液 | 酸性高锰酸钾稀溶液 | 溶液紫红色褪去 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西师大附中、鹰潭一中高三理综联考化学试卷(解析版) 题型:实验题
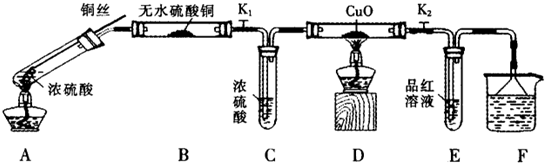
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验

(1)A中反应的化学方程式为:
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:

资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
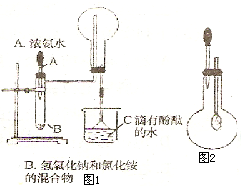 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸人约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴人试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸人2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴人烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸人约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴人试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸人2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴人烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题: NH3↑+H2O;⑤NH4Cl会分解释放出NH3.
NH3↑+H2O;⑤NH4Cl会分解释放出NH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com