
【题目】NiSO4易溶于水,其水溶液呈酸性,有毒。主要用于电镀工业,也是金属镍离子的来源。NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

(1)NiSO4水溶液呈酸性原因是_________________________;
(2)向滤液Ⅱ中加入H2O2的离子方程式:_________________________;
(3)调滤液ⅡpH的目的是除去Fe3+,原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______;
(5)从d(NiSO4溶液)经______、______、______洗涤、干燥等操作可得到NiSO4·6H2O晶体;
(6)为了提高产率,分离得到NiSO4·6H2O后剩余液体要循环使用,则应该回流到流程中的______位置(填a、b、c、d)。
【答案】 Ni2+在水溶液中水解显酸性 2Fe2++H2O2+2H+=2Fe3++2H2O 3.6×10-4 用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净 增大NiSO4的浓度(或富集NiSO4) 蒸发浓缩 冷却结晶 过滤 d
【解析】废渣(除含镍外,还含有Cu、Zn、Fe等元素),在硫酸溶解后过滤,除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化亚铁可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液pH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,则
(1)Ni2+在水溶液中水解,因此硫酸镍溶液显酸性;(2)对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,加入H2O2的离子方程式为:22Fe2++H2O2+2H+=2Fe3++2H2O;(3)调滤液ⅡpH的目的是除去Fe3+,Fe3++3H2O![]() Fe(OH)3+3H+,依据水解平衡常数Kh=c3(H+)c[Fe(OH)3]/c(Fe3+)= c3(H+)c[Fe(OH)3]×c3(OH)/c(Fe3+)×c3(OH)=(Kw)3/Ksp=(1014)3/2.8×1039≈3.6×10-4;检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,因此这两步操作的目的是增大NiSO4的浓度(或富集NiSO4);(5)得到的NiSO4溶液经过蒸发浓缩、冷却结晶、过滤、洗涤等操作;(6)为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用。
Fe(OH)3+3H+,依据水解平衡常数Kh=c3(H+)c[Fe(OH)3]/c(Fe3+)= c3(H+)c[Fe(OH)3]×c3(OH)/c(Fe3+)×c3(OH)=(Kw)3/Ksp=(1014)3/2.8×1039≈3.6×10-4;检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,因此这两步操作的目的是增大NiSO4的浓度(或富集NiSO4);(5)得到的NiSO4溶液经过蒸发浓缩、冷却结晶、过滤、洗涤等操作;(6)为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列实验与物质微粒大小无直接关系的是

A. 用水分离四氯化碳和苯的混合物
B. 蒸馏完毕时,先关闭冷凝水,再停止加热
C. 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒 2~3 次,并将洗涤液一并倒入烧杯中稀释
D. 将称取的NaOH 固体在烧杯中溶解,待冷却后,再转移至容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子,W原子的2p轨道上有3个未成对电子。
(1)Y与W、Z可形成多种化合物。
①元素Y与Z中电负性较大的是_________________(用元素符号描述)。
②离子ZY32-的空间构型为_______________ (用文字描述),杂化方式______________。
③ZY2空间构型_________,杂化方式________,分子的极性________(填“极性”或“非极性”)。
④元素Y与W中第一电离能较大的是___________________(用元素符号描述)。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是_____________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。
①基态X2+的电子排布式是________________。
②1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为___________。
③画出X原子的价电子排布图___________________;
④ [X(CN)5(NH3)]3-配离子中存在的化学键类型有_____________(填序号):
a、配位键 b、氢键 c、极性共价键 d、非极性共价键 e、离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性
mol·L-1,说明该溶液呈中性
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学探究性学习小组拟用锌粒与足量稀盐酸反应测定通常状况(约20 ℃,1 atm)下H2的气体摩尔体积。设计实验装置和实验步骤如下:
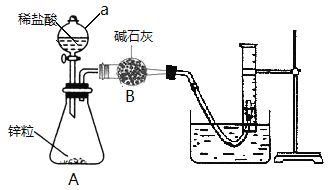
①连接如图所示装置,并检查装置的气密性
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为m g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为n g;
⑦处理数据等。
(1)仪器a的名称为_____________。
(2)写出锥形瓶中发生反应的离子方程式____________________________________________________________。
(3)写出检查装置A气密性的方法______________________________________________________________________。
(4)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=__________________________L·mol-1(用含m、b、n等字母的代数式表示)。
(5)若拆除B仪器(其他仪器不变),_______________________________(填“会”或“不会”)对本实验产生影响,理由是______________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素性质的递变规律不正确的是
A. Na、Mg、Al的金属性依次减弱 B. H2S、H2O、HF的稳定性依次减弱
C. Cl-、Br-、I-还原性依次增强 D. Na、K、Rb的原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是:
A. l6O与 l8O的转化可以通过化学反应实现
B. 灼烧氯化钠时火焰呈黄色,那是发生了化学反应
C. 碱性氧化物一定是金属氧化物
D. 只由一种元素组成的物质一定是纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com