
| A. | ${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素 | |
| B. | 乙二醇(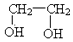 )和甘油( )和甘油(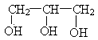 )互为同系物 )互为同系物 | |
| C. | 干冰和CO2互为同分异构体 | |
| D. | 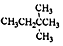 的名称是3,3-二甲基丁烷 的名称是3,3-二甲基丁烷 |
分析 A.原子符合左下角为质子数,左上角为质量数,质子数+中子数=质量数;
B.结构相似组成上相差CH2原子团的有机物互为同系物;
C.分子式相同结构不同的有机物互为同分异构体;
D.物质为烷烃,选取最长碳链为主碳链,离取代基进的一端编号确定支链位置,写出物质名称.
解答 解:A.${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素,故A正确;
B.乙醇和甘油官能团个数不同,不是同分异构体,故B错误;
C.干冰为二氧化碳是同种物质,不是同分异构体,故C错误;
D.物质名称2,2-二甲基丁烷,故D错误;
故选A.
点评 本题考查了原子结构、同系物、同分异构体、烷烃命名等知识点,掌握基础是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色,不能说明SO2具有漂白性 | |
| B. | AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 | |
| C. | 向FeBr2溶液中通入过量Cl2,加CCl4振荡静置,上层液体无色、下层为橙红色 | |
| D. | 将Cl2通入Na2SO3溶液中,检验是否有SO42-生成,可向该溶液中滴加足量盐酸酸化的Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | B. | Na2CO3+CO2+H2O═2NaHCO3 | ||
| C. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | D. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测出0.010mol/L氨水的pH为10 | |
| B. | 用pH试纸测定0.10mol/LNH4Cl溶液为pH<7 | |
| C. | 取出10mL0.010mol/L氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4C1晶体少量,颜色变浅 | |
| D. | 取出10mL0.010mol/L氨水,滴入2滴酚酞溶液,显粉红色,再稀盐酸少量,颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4L的Cl2与足量水反应中电子转移了2NA | |
| B. | 0.1mol/LK2SO4溶液中含有0.2NA个阳离子 | |
| C. | 常温常压下,22.4LO2气体的分子数小于NA | |
| D. | 20g D2O所含的中子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2×10-3mol•L-1 | B. | 1.2×10-9mol•L-1 | C. | 2.4×10-5mol•L-1 | D. | 3.2×10-6mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com