
【题目】在某温度时,将nmolL-1氨水滴入10mL1.0molL-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A.a点Kw=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时NH4Cl水解常数为(n-1)×10-7molL-1(用n表示)
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
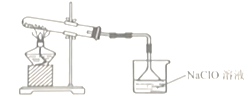
【题目】肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO + 2NH3 = N2H4 + NaCl + H2O制取。某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O)
5NaCl + NaClO3 + 3H2O)

①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。制取氨气的化学方程式为_______。
(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。写出该反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是
A.离子的还原性:C3-<D-B.离子半径:C>D>B>A
C.原子序数: d>c>b>aD.单质的还原性: A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素 X、Y、Z、M、W 的原子序数与其某常见化合价的关系如图所示,下列关系不正确的是

A.元素 X 可能为锂
B.原子半径大小:r(M)>r(W)
C.Z 元素是形成化合物种类最多的元素
D.气态氢化物的还原性:YH3<MH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构与性质的说法正确的是
A.标况下,22.4 L C2H2中所含的π键数和18 g冰中所含的氢键数均为2NA
B.由于氢键的作用NH3、H2O、HF的沸点反常,且高低顺序为HF>H2O>NH3
C.VSEPR模型就是分子的空间构型
D.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式为_________。向反应后的溶液中通入少量CO2,反应的离子方程式为_______________。
(2)在100mLFeBr2溶液中通入标准状况下2.24LCl2,溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为______________(结果保留两位小数)。
(3)三氟化氮(NF3)是一种无色无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________________,反应中生成0.2mol HNO3,转移的电子数目为__________。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com