
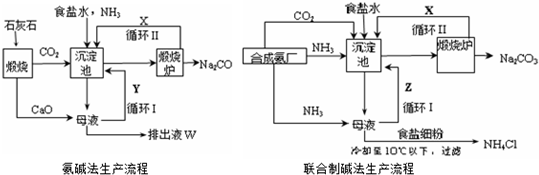
| ||
| 168 |
| a-x |
| 62 |
| a-b |
| 84b-53a |
| 31 |
| 84b-53a |
| 31a |
| (84b-53c) |
| 31a |


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
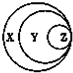 如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )| 选项 | X | Y | Z |
| A | 混合物 | 溶液 | 胶体 |
| B | 酸 | 强酸 | 硫酸 |
| C | 纯净物 | 无机物 | 甲烷 |
| D | 化合物 | 碱性氧化物 | 酸性氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
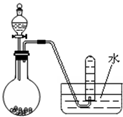
| A、用浓盐酸跟二氧化锰反应制取Cl2 |
| B、用浓氨水和生石灰制取NH3 |
| C、用电石跟水反应制取C2H2 |
| D、用浓硝酸跟铜反应制取NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com