
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a﹤b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+ c( C2O42-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>①
【答案】B
【解析】
根据H2S为二元弱酸,分步电离,同时还存在水的电离,写出电离方程式进行分析判断A;
根据一水合氨为弱碱,弱碱在稀释过程中溶液的pH变化比强碱溶液小分析判断B;
H2C2O4是二元弱酸,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断C;
钠离子不水解,可以根据酸根离子对应酸的酸性强弱判断pH相同的①CH3COONa、②NaHCO3、③NaClO的浓度大小,钠离子浓度与三者浓度相等分析判断D。
A、H2S为二元弱酸,分步电离,H2S溶液中,存在H2SH++HS-、HS-H++S2-、H2OH++OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1
>c(HS-),故A错误;
B、加水稀释促进氨水电离,pH=a的氨水溶液,稀释10倍后,溶液中的氢氧根离子浓度大于原来的![]() ,其pH=b,则a<b+1,故B正确;
,其pH=b,则a<b+1,故B正确;
C、H2C2O4是二元弱酸,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),故C错误;
D、酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根离子对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,则pH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的浓度由大到小为①>②>③,即c(Na+)大小为:①>②>③,故D错误。
故答案选B。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分离方法的叙述中,不正确的是 ( )
A.用过滤的方法分离溶液和胶体
B.用四氯化碳萃取碘水中的碘
C.用蒸馏的方法将自来水制成蒸馏水
D.用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A. v(A)=0.15molL-1min-1 B. v(B)=0.01molL-1s-1
C. v(C)=0.40molL-1min-1 D. v(D)=0.0075molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述不正确的是

A. 反应的化学方程式为:3N ![]() 2M
2M
B. t2时,正、逆反应速率不相等
C. t3时,正反应速率等于逆反应速率,达到平衡
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)═2NO(g)+O2(g)在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示反应达到平衡状态的是
A. ①③⑤ B. ②④⑥ C. ②③④⑥ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
化学式 | NaF | NaCl | NaBr | NaI |
熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
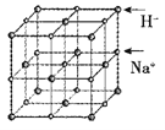
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
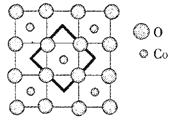
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是 ( )


A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最小
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com