
| A. | 电离能大的元素,不易失电子,易得到电子,表现非金属性 | |
| B. | 电离能大的元素其电负性必然也大 | |
| C. | 电负性最大的非金属元素形成的含氧酸的酸性最强 | |
| D. | 电离能最小的元素形成的氧化物的水化物的碱性最强 |
分析 A.金属性越强,第一电离能越小,非金属性越强,第一电离能越大,而稀有气体为稳定结构,第一电离能较大;
B.元素的第一电离能是指气态原子失去1个电子所需要最低的能量,吸引电子能力越大,电负性越大,电离能大的元素其电负性未必也大;
C.电负性最大的非金属元素为F元素;
D.金属性越强,其最高价氧化物对应的水化合物碱性越强,金属性越强,第一电离能越小.
解答 解:A.电离能大的元素,不易失电子,如He为2电子稳定结构,难失去电子,但He很难得到电子,故A错误;
B.零族元素单质最外层电子都达稳定结构,所以在周期表中0族元素的第一电离能最大,而不是电负性最大,故B错误;
C.F的电负性最大,非金属性最强,F元素没有对应的含氧酸,故C错误;
D.电离能最小的元素,金属性最强,形成的氧化物的水化物的碱性最强,故D正确;
故选D.
点评 本题考查元素的电负性、电离能,为高频考点,侧重电负性、电离能等衡量元素性质的知识点,综合性较强,属于易错题,题目难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.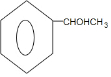 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机反应中常说的卤化、硝化、水化都属于取代反应 | |
| B. | 按系统命名法,有机物 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 分子式为C8H11N的有机物,分子内含苯环和氨基(-NH2)的同分异构体共14种 | |
| D. | 乙烯、氯乙烯、甲苯三种有机物分子内所有原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |

查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com