
某小组为研究原电池原理,设计如图装置,下列叙述正确的是
| A.装置I,铜片上有O2逸出 |
| B.装置I,锌片溶解,发生还原反应 |
| C.装置II,电池反应为:Zn+ Cu2+= Zn2++ Cu |
| D.装置II,外电路中,电子从锌电极流向铜电极 |
科目:高中化学 来源: 题型:单选题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是:( )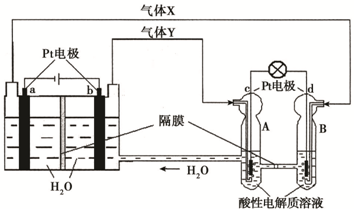
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2 + 2H2O+ 4e- = 4OH—
D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,用铅蓄电池电解100 g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5 g。下列说法正确的是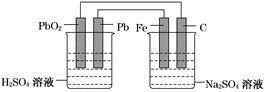
| A.电路中转移0.25 mol电子 |
| B.铅蓄电池中消耗0.5 mol H2SO4 |
| C.铅蓄电池的负极反应式为:PbSO4+2H2O-2e-===PbO2+4H++SO42- |
| D.Fe电极发生的电极反应为Fe-2e-===Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是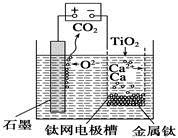
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某原电池装置如图所示。下列有关叙述中,正确的是( )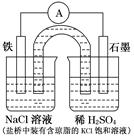
| A.Fe作正极,发生氧化反应 |
| B.负极反应:2H++2e-=H2↑ |
| C.工作一段时间后,两烧杯中溶液pH均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关电池的说法不正确的是( )
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将金属A和金属B分别放入稀H2SO4中有氢气生成。若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀,关于A、B的叙述正确的是( )
A.金属活动性A>B
B.还原性B>A
C.在后者装置中金属A发生还原反应,金属B发生氧化反应
D.金属B的表面有明显的气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
| C.电池反应的化学方程式为CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应为O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com