
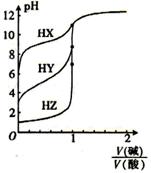
常温下,浓度均为0.1000mol/L的三种一元酸HX、HY、HZ溶液,分别用0.1000mol/L的NaOH溶液进行滴定,滴定曲线如图所示。下列有关叙述正确的是
A.NaOH溶液与三种酸的反应均是吸热反应
B.酸性强弱:HX>HY>HZ
C.滴定酸HY可用酚酞作指示剂
D.滴定三种酸都可用甲基橙作指示剂
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:
Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙醇的说法中正确的是( )
A.乙醇的密度比水小,遇水混合时浮在上层
B.乙醇在水中能电离出少量氢离子
C.乙醇分子中的氢均可被钠置换
D.在一定条件下,镁也可跟乙醇反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的叙述正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.NH3+H3O+=NH4++H2O说明结合H+的能力:H2O>NH3
C.FeCl2、Fe(OH)3均可通过化合反应制得
D.分子式为C2H4O2的化合物只能电离,不能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
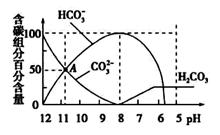
常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是
A.0.1 mol/L Na2CO3溶液中
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
B.在A点:c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.0.05 mol/L NaHCO3溶液的pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:
HCO +O
+O H-===CO
H-===CO +H2O
+H2O
C.少量CO2通入硅酸钠溶液中:
SiO +2CO2+2H2O===H2SiO3↓+2HCO
+2CO2+2H2O===H2SiO3↓+2HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.饱和氯水中:Cl-、NO 、Na+、SO
、Na+、SO
B.c(H+)=1.0×10-13mol/L溶液中:CO 、K+、SO
、K+、SO 、Br-
、Br-
C.Na2S溶液中:SO 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
D.pH=12的溶液中:NO 、I-、Na+、Al3+
、I-、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
②取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀;
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com