
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
某学校研究小组欲通过下列实验探究金属钠和金属铜的金属活动性强弱。
(1)将一粒金属钠和一块铜片分别盛在表面皿中,放在实验桌上,研究它们在空气中的稳定性,就此回答下面的问题:
①从研究物质性质的基本方法方面来说,采用的研究方法主要包括_______________ ____________。
②某同学将钠用小刀切割后放置在空气中一小会儿就发现钠块表面的变化是______________________________,这一过程说明了____________________,有关的化学反应方程式为____________________;若将钠块在空气中放置足够长时间,钠将最终变为____________(填化学式),而铜片则在一段时间内无明显变化。
(2)试设计其他实验比较钠、铜活动性强弱(试剂自选):_____________________________ ______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为25 ℃时,将0.23 g钠投入到100 g水中充分反应,假设反应后溶液体积为100 mL,则该溶液的pH为( )
A.1 B.10 C.12 D.13
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铝与稀硝酸溶液反应6H++2Al====2Al3++3H2↑
B.硝酸铝溶液中滴入氨水Al3++3OH-====Al(OH)3↓
C.硝酸铝溶液中滴 加过量的氢氧化钠溶液Al3++3OH-====Al(OH)3↓
加过量的氢氧化钠溶液Al3++3OH-====Al(OH)3↓
D.氧化铝与氢氧化钠溶液反应Al2O3+2OH-+3H2O====2[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中,A为空气中常见的气体单质、B、C、E是金属单质,D为非金属单质。已知:①I是一种常见的温室气体,E原子核内有12个质子②G为红色物质,反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
B+H能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
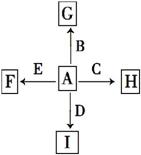
(1)分别写出F、G、H、I的化学式:
F________ G________ H________ I_______
(2)书写下列化学方程式:
C+G B+H___________________________________________________;
B+H___________________________________________________;
2 E+I
E+I 2F+D__________________________________________________。
2F+D__________________________________________________。
(3)C与NaOH溶液反应的化学方程式为___________________________,反应后溶液与过量化合物I反应的化学方程式为____________________________。
(4)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.铝和稀盐酸反应:Al+2H+=Al3++H2↑
B.稀硝酸和碳酸钙反应:2H++CO32ˉ=CO2↑+H2O
C.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42ˉ=BaSO4↓
D.用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a + b > c + d
C.Z的体积分数减小 D.X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。 现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)  2Al2O3(s)+3TiC(s)
2Al2O3(s)+3TiC(s)
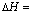 -1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
-1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
(3)硅与铝同周期,地壳里硅铝的含量是硅________铝(填>,<或=); Na2CaSi6O14是硅酸盐玻璃的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
|
 3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________.
3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com