
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | Na2O熔融状态下能导电,所以Na2O是电解质 | |
| D. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 |
分析 A、根据酸电离出的氢离子数目将酸分为一元酸、二元酸等;
B、能和碱反应生成盐和水的氧化物属于酸性氧化物,能和酸反应生成盐和水的氧化物属于碱性氧化物,酸性氧化物可以是金属氧化物;
C、Na2O是离子化合物,熔融电离出钠离子和氧离子;
D、胶体区别于其他分散系的本质特征是分散质微粒直径的大小.
解答 解:A、根据酸分子能电离出的氢离子个数,将酸分为一元酸、二元酸等,如H3BO3,1个酸分子中含有的H原子个数为3个,但电离出1个氢离子,属于一元酸,故A错误;
B、根据能和碱反应生成盐和水的氧化物属于酸性氧化物,能和酸反应生成盐和水的氧化物属于碱性氧化物可知,CO2、P2O5是酸性氧化物,Mn2O7也是酸性氧化物,故B错误;
C、Na2O之所以是电解质,是因为其在熔融状态下电离出自由移动的离子能导电,故C正确;
D、微粒直径在1nm-100nm分散质形成的分散系为胶体,小于1nm分散质形成的分散系为溶液,大于100nm分散质形成的分散系为浊液,故D错误;
故选C.
点评 本题考查了物质分类的方法,氧化物、酸的分类、电解质和胶体概念的理解应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O?CO2+H2 | B. | H2PO4-+H2O?HPO42-+H3O+ | ||
| C. | Cl-+H2O?HCl+OH- | D. | HS-+H2O?H2S+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
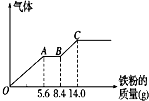 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| C. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,不能证明晶体中无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++NH2-.
NH4++NH2-. NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氢氧化钠溶液中加入铝Al+2OH-═AlO2-+H2↑ | |
| B. | 氯化铝溶于水发生水解Al3++3H2O═Al(OH)3+3H+ | |
| C. | 明矾溶液中加入少量的氢氧化钡溶液Al3++3OH-═Al(OH)3↓ | |
| D. | 硫酸铝溶液中加入过量氢氧化钠溶液Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com