
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
分析 (1)根据乙醇分子中易形成氢键及氢键对熔沸点的影响分析;
(2)实验目的是回收乙醇和乙酸,根据沸点可知需要先回收乙醇,再回收乙酸,根据乙酸具有挥发性可知A为烧碱溶液;乙酸乙酯和乙酸都能够与氢氧化钠溶液发生反应;
(3)根据表中各物质的沸点判断在70℃~85℃时馏出物的主要成分;
(4)加入B的目的是将乙酸钠转化成乙酸,结合浓盐酸具有挥发性判断选用的酸;
(5)最后蒸馏获得的是乙酸,结合乙酸的沸点判断控制的温度;
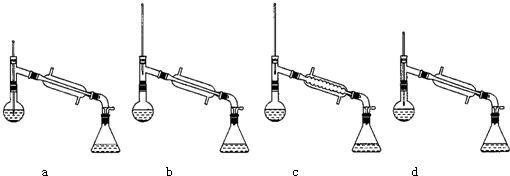
(6)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;如果蒸馏前忘记加沸石,液体温度已接近沸点时,需要移开热源,等到温度降低后重新加入沸石.
解答 解:(l)醇类分子间能形成氢键,会导致沸点升高,而丙酮分子之间不易形成氢键,氢键大大增加了分子间作用力,所以乙醇的沸点比丙酮沸点高,
故答案为:乙醇分子之间易形成氢键;
(2)根据表中数据可知,需要先收集乙醇,然后收集乙酸,且乙酸易挥发,所以应该先加入A烧碱溶液,发生反应为:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O,从而将乙酸乙酯、乙酸转化成乙酸钠、乙醇,
故答案为:A;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O;
(3)根据乙醇、丙酮、乙酸和乙酸乙酯的沸点可知,在70℃~85℃时馏出物的主要成分为乙醇,
故答案为:乙醇;
(4)加入试剂B的目的是将乙酸钠转化成乙酸,选用的应该为强酸,由于浓盐酸具有挥发性,应该用浓硫酸,所以选B,
故答案为:B;
(5)最后回收的是乙酸,乙酸的沸点为117.9℃,所以应该将温度控制在117.9℃左右,
故答案为:117.9℃左右;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;
如果蒸馏前忘记加沸石,液体温度已接近沸点时,正确的操作方法为:移开热源,待温度降低,再投入沸石,重新加热,
故答案为:b;移开热源,待温度降低,再投入沸石,重新加热.
点评 本题考查了物质分离、提纯方法及化学实验操作方法的综合应用,题目难度中等,明确实验目的为解答关键,注意掌握常见的化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
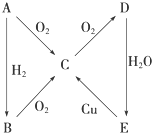 根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式:
根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| D. | 向足量铝粉与稀盐酸反应后的溶液中滴加碳酸氢钠溶液:3HCO3-+Al3+═Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应I | 反应Ⅱ | 描述 |
| A | CuSO4+Fe- | CuSO4+Na- | 向CuSO4溶液中加入较活泼的金属单质均可以置换得到单质铜 |
| B | 浓氨水与浓盐酸 | 浓氨水与浓硝酸 | 在空气中靠近均能产生白烟 |
| C | NaOH+MgCl2- | NaOH+AlCl3- | 过量NaOH溶液加入溶液中均生成白色沉淀 |
| D | Ca(ClO)2+CO2- | Ca(ClO)2+SO2- | 向漂白粉溶液中通入足量的气体反应后,所得的溶液均具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取10.00 mL 1.0mol•L-1的盐酸于100mL容量瓶中,加水定容至刻度,可配得0.1mol•L-1的盐酸 | |
| B. | 做焰色反应时,若连续做两个样品,应将铂丝用硫酸洗净并灼烧到无色 | |
| C. | 取试样与氢氧化钠浓溶液共热,产生能使湿润红色石蕊试纸变蓝色的气体,则说明试样中有NH4+ | |
| D. | 直接用分液的方法分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/LNaHCO3溶液中通入CO2:c(Na+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol/LNaF溶液中通入HCl:c(Na+)>c(HF)=c(Cl-) | |
| C. | 0.10mol/LNa2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/LNaHSO3溶液通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com