
| A. | 灼烧氯化铷时,火焰有特殊颜色 | |
| B. | 硝酸铷,不溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
分析 A.金属灼烧都会发出不同的焰色;
B.依据同主族元素性质的相似性解答;
C.碱金属从上到下单质的熔沸点依次降低;
D.元素的金属性越强,其相应碱的碱性越强,
解答 解:A.灼烧氯化铷时,火焰有特殊颜色,属于金属元素的焰色反应,故A正确;
B.碱金属元素的硝酸盐都易溶于水,可知硝酸銣易溶于水,故B错误;
C.碱金属从上到下单质的熔沸点依次降低,所以在钠、钾、铷三种单质中,钠的熔点最高,故C错误;
D.Rb位于第五周期第IA族,在K元素的下方,金属性强于钾,所以氢氧化銣碱性强于氢氧化钾,是强碱,故D错误;
故选:A.
点评 本题考查了碱金属元素的性质,熟悉同主族元素性质的相似性与递变性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
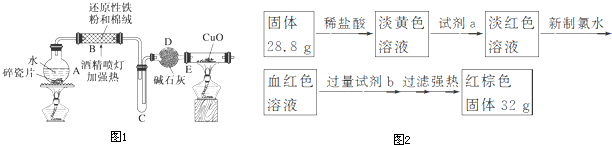
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 馒头在咀嚼过程中产生甜味 | |
| B. | 三氯化铁溶液长期放置产生红褐色固体 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,析出沉淀 | |
| D. | 植物油长期放置发生“酸败产生刺激性气味” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | MgBr2的形成过程用电子式表示为: | D. | Cl-的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体碘单质中既存在非极性共价键,还存在范德华力 | |
| B. | NaCl晶胞中每个Na+周围距离最近且相等的Cl-有6个,构成空间构型为正八面体 | |
| C. | 能够用来衡量化学键强弱的物理量有:原子化热、晶格能、键能、氢键等 | |
| D. | NH4+中4个N-H键的键长、键能相同,空间构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡与盐酸溶液反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | 石灰石在高温下的分解反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
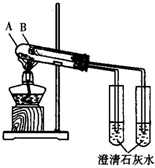 研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.
研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com