
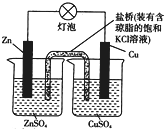
| A. | 正极反应为Zn-2e-═Zn2+ | B. | 电池反应为Zn2++Cu═Zn+Cu2+ | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向ZnSO溶液 |
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过量氨水除去Al3+溶液中的少量Fe3+ | |
| B. | 将混合气体通过灼热的铜网除去N2中的少量O2 | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | 用饱和NaHCO3溶液除去混在H2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
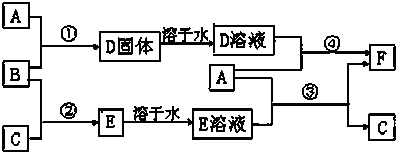
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| B. | 加热蒸发K2CO3溶液获得K2CO3晶体 | |
| C. | 加热蒸发FeCl2溶液制取Fe(OH)2固体 | |
| D. | 加热蒸发MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
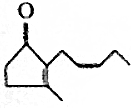 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
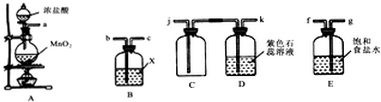
| 实验装置设计. |  (注明所用试剂及气体流向) (注明所用试剂及气体流向)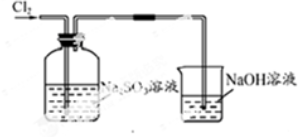 |
| 实验步驟及现象 | 连接好装置,将氯气通入亚硫酸钠溶液中,充分反应.取少量所得溶液与试管,滴入几滴氯化钡,有白色沉淀,再加入少量盐酸,沉淀不溶解. |
| 离子方程式 | Cl2+SO32-+H2O=2Cl-+SO42-+2H+; SO42-+Ba2+=BaSO4↓ |
| 结论 | Na2SO3具有还原性,能被氯气氧化成Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
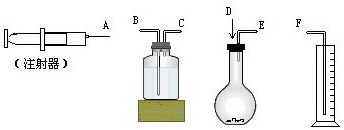 现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).
现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com