
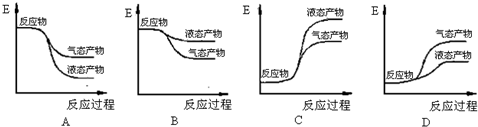
| ②-① |
| 2 |
| △H2-△H1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
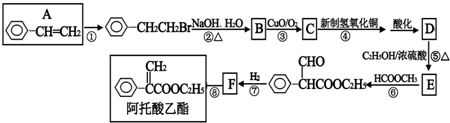
查看答案和解析>>
科目:高中化学 来源: 题型:
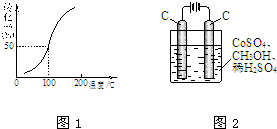 甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.
甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
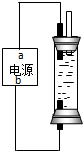 NaClO具有强氧化性,其溶液可用于游泳池及环境消毒.
NaClO具有强氧化性,其溶液可用于游泳池及环境消毒.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加少量的水形成绿色溶液 |
| B、检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 |
| C、在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 |
| D、铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取代,4 mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成,取代,3 mol Cl2 |
| D、加成,消去,取代,3 mol Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com