
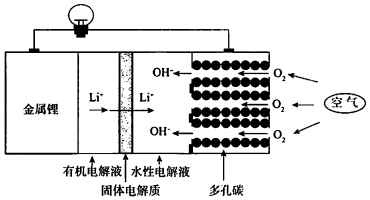
| A. | 回收水性电解液可制取锂 | |
| B. | 可将有机电解液改为水溶液 | |
| C. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| D. | 电池总反应方程式为4Li+O2+2H2O═4LiOH |
分析 在锂空气电池中,锂失电子作负极,负极是有机电解液,锂不与有该电解液直接反应,负极反应式为:4Li-4e-=4Li+,以空气中的氧气作为正极反应物,正极为水性电解液,氧气得电子生成氢氧根离子,正极反应为:O2+2H2O+4e-=4OH-,据此解答.
解答 解:A.Li在负极失电子生成Li+,Li+向正极移动,正极区Li+与氢氧根离子结合形成LiOH,可以回收利用,故A正确;
B.金属锂能与水反应生成氢气,所以电池中的有机电解液不可以用水溶液代替,故B错误;
C.正极上是氧气得电子生成氢氧根离子,则电极反应式为O2+4e-+2H2O=4OH-,故C正确;
D.负极反应为4Li-4e-=4Li+,正极反应为O2+2H2O+4e-=4OH-,则总反应为4Li+O2+2H2O=4LiOH,故D正确;
故选B.
点评 本题考查原电池的工作原理,明确原电池正负极反应是解题关键,侧重于考查学生的分析能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
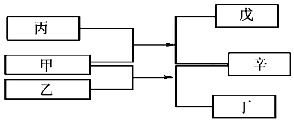 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲学生用电子天平称取NaOH固体1.220g | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸 | |
| D. | 丁学生用50mL 量筒量取46.70mL浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
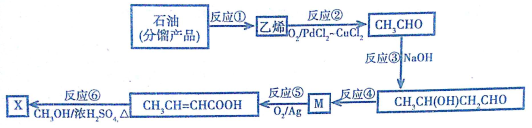
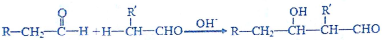
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
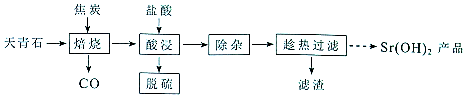
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
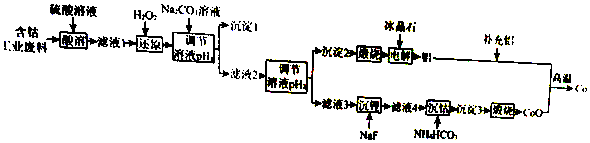
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com