
| A. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1mol Na2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18g NH4+所含的电子数11NA |
分析 A、求出混合气体的物质的量,然后根据分子个数N=nNA来计算;
B、HCO3-在溶液中能部分电离为CO32-又能部分水解为H2CO3;
C、过氧化钠和二氧化碳的反应为歧化反应;
D、求出铵根离子的物质的量,然后根据铵根离子中含10个电子来分析.
解答 解:A、标况下22.4L混合气体的物质的量为1mol,故分子个数N=nNA=NA个,故A正确;
B、HCO3-在溶液中能部分电离为CO32-又能部分水解为H2CO3,故溶液中的HCO3-、CO32-、H2CO3个数之和为0.1NA个,故B错误;
C、过氧化钠和二氧化碳的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故C错误;
D、18g铵根离子的物质的量为1mol,而铵根离子中含10个电子,故1mol铵根离子中含10NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
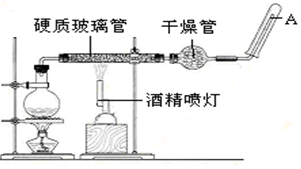
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
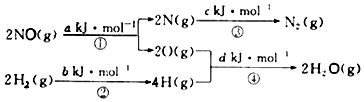
| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
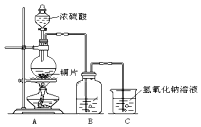 如图为足量铜与浓硫酸反应的装置.请回答:
如图为足量铜与浓硫酸反应的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
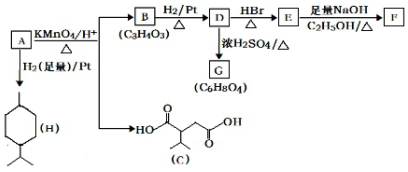
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$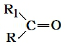 +R2COOH
+R2COOH .
. .
.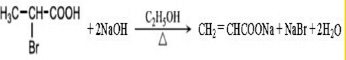 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
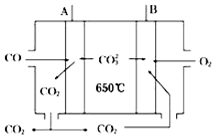 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
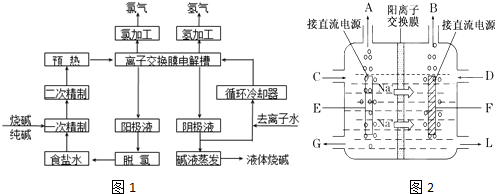
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com