
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是__________________,通入过量二氧化碳的离子方程式是_________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
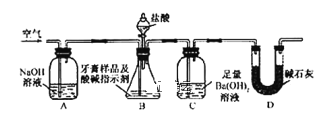
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是________。
(5)下列各项措施中,不能提高测定准确度的是___(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.0g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________。
【答案】Al(OH)3+OH-═AlO2-+2H2O(也可写为Al(OH)3+OH-═[Al(OH)4]-) 通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解 AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收 Ba(OH)2+CO2═BaCO3↓+H2O cd 25% B中的水蒸气、HC1气体等进人装置C中会导致测量结果偏高
【解析】
Ⅰ.(1)Al(OH)3溶于NaOH溶液生成NaAlO2和H2O,离子方程式为Al(OH)3+OH-═AlO2-+2H2O(也可写为Al(OH)3+OH-═[Al(OH)4]-),
故答案为:Al(OH)3+OH-═AlO2-+2H2O(也可写为Al(OH)3+OH-═[Al(OH)4]-);
(2)NaAlO2溶液呈碱性,通入过量CO2时沉淀Al(OH)3和NaHCO3,Al(OH)3是两性氢氧化物,能溶于强酸溶液,所以产生的沉淀溶于稀盐酸中,所以看到的现象是:通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解,离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
Ⅱ.空气中含有CO2,所以A装置能吸收空气中CO2,通入空气的目的是将B中产生的CO2全部排入C中,使CO2完全被Ba(OH)2吸收,D装置能吸收水蒸气、二氧化碳,防止C中右边导管进入空气;
(3)实验过程中需持续缓缓通入空气,能把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收,否则使测定结果偏小,
故答案为:把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收;
(4)Ba(OH)2和CO2反应BaCO3沉淀和水,化学方程式为Ba(OH)2+CO2═BaCO3↓+H2O,故答案为:Ba(OH)2+CO2═BaCO3↓+H2O;
(5)a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a不符合;
b、滴加盐酸过快,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b不符合;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c符合;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,不影响CO2,不能提高测定准确度,故d符合;
故选:cd;
(6)根据C原子守恒得n(CaCO3)=n(BaCO3),所以m(CaCO3)=![]() ×100g/mol
×100g/mol
=2g,其质量分数=![]() ×100%=25%,
×100%=25%,
故答案为:25%。
(7)直接测量C装置实验前后的质量,可求出生成的气体的质量,但因从B中出来的还有水蒸气、HCl气体等,会导致测量结果偏高。
答案为:B中的水蒸气、HC1气体等进人装置C中会导致测量结果偏高。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
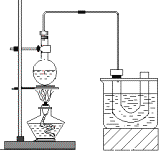
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇(密度为0.789g/cm3)、28mL78%浓硫酸,然后加入研细的23g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式___________________________________。
(2)在大烧杯加入冰水的作用是____________________________________。溴乙烷的水溶性小于乙醇的水溶性,其原因是_________________________。反应一段时间后,U型管内可观察到的现象是___________________________。
(3)反应时若温度过高会有副反应发生,写出发生有机副反应的化学方程式________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,最好选择下列试剂中的__________(填序号)
A.H2O B.CCl4 C.Na2SO3溶液 D.NaOH溶液
除杂所需的主要玻璃仪器是__________________(填仪器名称)。要进一步制得纯净的溴乙烷,可再用水洗,然后加入无水CaCl2,再进行_________________(填操作名称)。
(5)最后制得溴乙烷产品14.2g,求上述实验中溴乙烷的产率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制480mL0.2mol·L-1的NaOH溶液。
(1)通过计算可知,应用托盘天平称量_____克NaOH固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____。
(3)从下面选出所需的操作并写出正确的顺序_____(填字母)。
A.洗涤 B.冷却 C.量取 D.称量 E.定容 F.转移溶液 G.稀释 H.溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)。
①定容时加蒸馏水不慎超过了刻度_____;
②容量瓶不干燥,有一定的水分_____;
③定容时仰视观察到液面刚好到达刻度线_____。
(5)该NaOH溶液与2.24L氯气(STP)下恰好完全反应,需氢氧化钠溶液_____mL。
(6)用18mol·L-1的硫酸配制100mL1.0 mol·L-1硫酸,实验时应选用的仪器是_____(填编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示物质相互转换关系:

试回答:
(1)写出B的化学式____________、C溶液是______________。
(2)写出由E转变成F发生反应的化学方程式_______________。
(3)鉴别G溶液中阳离子的操作方法及实验现象:__________________。
(4)向G溶液中加入A的离子方程式____________________。
(5)写出D溶液中加入AgNO3得到白色沉淀的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.![]()
B.![]()
C.![]()
D.![]()
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2仅体现还原性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:![]() 。已知该反应中H2O2只发生了如下过程:H2O2→O2。
。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平_______________________________________
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),发生以下反应:![]() ,试指出生成物A的化学式为________。
,试指出生成物A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是_____(填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为______mol。
(3)用双线桥法表示该氧化还原反应中电子转移的方向和数目_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:

(1)每一个晶胞中均摊到________个钨原子。
(2)计算晶胞的边长a________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙烯和乙醛都能使溴水褪色,发生的反应类型都是加成反应
B. ![]() 分子中至少有9个碳原子处于同一平面上
分子中至少有9个碳原子处于同一平面上
C. 分子式为C7H8O ,可与FeCl3发生显色反应的有机物结构有3种
D. 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液先中和甲酸,再做银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有c(CH3COOH)+c(CH3COO)=0.1 mol·L1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是
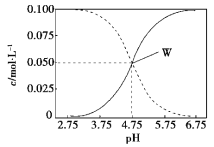
A. pH=5.5的溶液中:c(CH3COO—)>c(CH3COOH)>c(H+)>c(OH)
B. pH=3.5的溶液中:c(Na+)+c(H+)c(OH)+c(CH3COOH)=0.1 mol·L1
C. W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)
D. 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com