
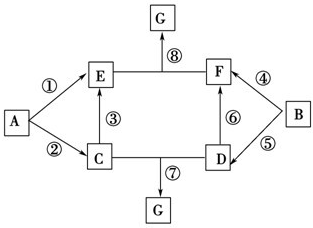
 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:
| A、大气污染物主要来自化石燃料和工业生产过程产生的废气 |
| B、形成酸雨的主要物质是硫氧化物和氮氧化物(NOX) |
| C、绿色化学的核心就是在生产过程中减少污染 |
| D、水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
| A、反应①是放热反应 |
| B、反应②是放热反应 |
| C、反应②在973K时增大压强,K2增大 |
| D、在常温下反应①一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
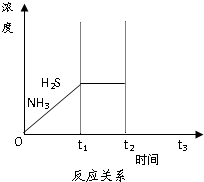 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
科目:高中化学 来源: 题型:
| c HCN-c CN- |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com