
【题目】在某温度下,将3molA和2mol B充入一密闭容器中,发生反应:aA(g)+B(g)![]() C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为
A. 60%B. 40%C. 24%D. 4%
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
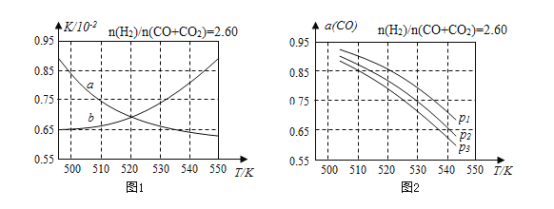
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
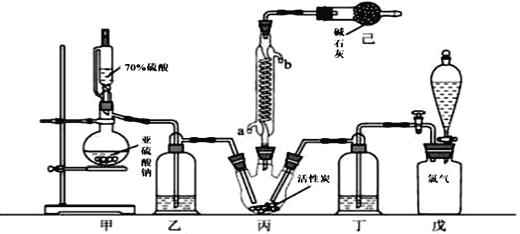
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
A.在接触法制取硫酸工艺中,该反应在沸腾炉内发生
B.如果用 18O2代替O2发生上述反应,则经过一段时间可测得容器中存在S18O2、S18O3
C.2 mol SO2与2 mol O2充分反应后放出a kJ的热量
D.该反应达到平衡后,c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙是电化学实验装置,请回答下列问题:

(1)若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是____________。
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I-生成了I2。若A气体和I2按物质的量之比为5∶1反应,且生成两种酸,该反应的化学方程式为_________。
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01 mol电子转移后停止实验,烧杯中溶液的体积为100 mL,则溶液混匀后的c(OH-)=_____。
(2)若甲、乙两烧杯中均盛放CuSO4溶液。
①甲中铁棒上的电极反应式为_______________。
②乙中总反应的离子方程式为_________________。
③如果起始时乙中盛放100 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的c(H+)=0.1mol/L,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____ (填写物质的化学式)______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ· mol-1
③2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ· mol-1
若某反应Ⅰ的平衡常数表达式为K=![]() 请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
(2)一定温度下,向体积为V L的密闭容器中充入一定量的NO和CO,发生反应Ⅰ。
①下列说法正确的是____。
A 当容器内气体压强不再发生变化时,说明反应已达到平衡状态
B 当v(CO2)=v(CO)时,说明反应已达到平衡状态
C 达到平衡后,若向容器中再充入一定量NO,则NO转化率将减小
D 达到平衡后,若再升高温度,由于逆反应速率增大,正反应速率减小,因此平衡向逆反应方向移动
②若反应在t1时刻达到平衡状态,在其他条件不变的情况下,t2时刻通过缩小容器体积使压强增大到原来的2倍,t3时刻达到新的平衡状态。请在图中补充画出t2~t4时段c(NO)的变化曲线: ____

(3)分离高炉煤气得到的CO与空气可设计成燃料电池而除去(以KOH溶液为电解质溶液)。写出该电池的负极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ 3B(g)![]() 2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④①B.④③②①C.③④②①D.②④③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com