
常温下,下列各组离子在水溶液中能大量共存的是
A.NH4+、Ag+、CO32—、SO42— B.Fe2+、H+、NO3—、Cl-
C.Al3+、NH4+、HCO3—、Cl- D.K+、Na+、NO3—、SO42—
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法错误的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C.淀粉、油脂、蛋白质都能水解,但水解产物不同
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:实验题
(15分)氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
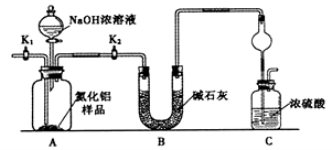
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ___________ ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
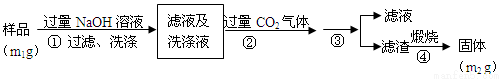
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(NaOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
③ | 0.2 | 0.1 | 4.8 |
④ | 0.1 | 0.2 | y |
下列判断正确的是
A.实验①反应后的溶液中:c(HA)约为 mol·L-1
mol·L-1
B.实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-)
C.实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-)
D.实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
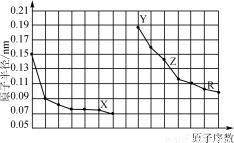
A.X、R的最高化合价相同
B.简单离子的半径:X>Y>Z
C.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
D.电解熔融的X与Z构成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:简答题
(15分)氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4= kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式: 。
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为: ;为抑制肼的分解,可采取的合理措施有 (任写一种)。
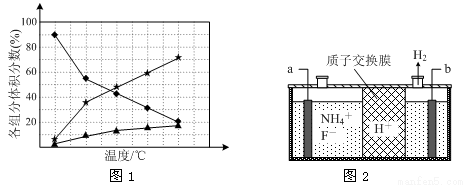
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
①氮化硅的化学式为 。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 将Al2(SO4)3、NaOH溶液相互滴加 | 鉴别Al2(SO4)3、NaOH溶液 |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:填空题
(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= 。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
向100 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示。下列分析错误的是.
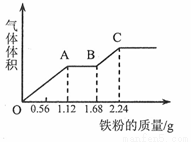
A.原混合酸溶液的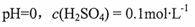
B.OA段的反应为:
C.AB段的反应为: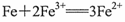
D.BC段气体产物为氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com