
【题目】(1)0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为____________。
(2)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_________________(填序号)。
(3)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为__________
(4)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是___________。
(5)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是__________(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
【答案】24.5 L·mol-1 ②>①>④>③ 64 143.0 12.5 a d
【解析】
(1)根据Vm=V/n进行计算。
(2)根据n=m/M=V/Vm进行换算,然后比较。
(3)根据n=m/M=V/Vm,计算其物质的量,然后计算其摩尔质量,根据相对分子质量和摩尔质量在数值上相等进行分析。
(4)根据实际实验中的容量瓶的规格计算需要的物质的质量。
(5)根据溶液稀释过程中溶质物质的量不变进行计算浓溶液的体积,再根据c=n/V分析实验过程中的误差。
(1) 0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为Vm = ![]() =24.5 L·mol-1;
=24.5 L·mol-1;
(2) 有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,物质的量为0.5mol,标况下体积为11.2L,③3.4 g H2S物质的量为0.1mol,标况下体积为2.24L,④0.2 mol NH3,标况下体积为4.48L,则其体积按从大到小的顺序为:②>①>④>③;
(3) 标准状况下,测得1.92g某气体的体积为672 mL,其物质的量为n=![]() =0.03mol,则此气体的摩尔质量为M=
=0.03mol,则此气体的摩尔质量为M=![]() =64g/mol,相对分子质量为64;
=64g/mol,相对分子质量为64;
(4) 实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,实际使用1000mL容量瓶配制1000mL溶液,所以应称取Na2CO3·10H2O的质量是0.5mol/L×1L×286g/mol=143.0g。
(5) ①需要12mol·L-1浓盐酸的体积为V=0.5L×0.3 mol·L-1÷12mol·L-1=0.0125L,即12.5mL;
②a.用量筒量取浓盐酸时俯视观察凹液面,会使量取浓盐酸的体积减小,配制的溶液浓度偏小;
b.量取浓盐酸的量筒不需要进行洗涤,所以将洗涤液转移到容量瓶中会使盐酸的浓度增大;
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中,当冷却时溶液的体积变小,浓度变大;
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,溶液的体积变大,浓度变小;
e.容量瓶洗涤干净后未干燥,对配制溶液没有影响;
故选ad。


科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题.
(1)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为H2SO4溶液),通过装置Ⅱ实现铁棒镀铜。

①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是___________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度_______;
③若实验过程中Ⅱ中的铜片质量减少了2.56g,则Ⅰ中理论上消耗CH4的体积(标准状况)______L。
(2)若将装置Ⅱ中的两电极均改为石墨惰性电极:
①写出装置Ⅱ中发生的总化学反应方式________________________________。
②若用Ⅱ电解200 mL 0.05 mol·L-1的CuSO4溶液,一段时间后溶液中的Cu2+恰好完全析出,恢复至室温,溶液pH=__________(忽略电解过程中溶液体积变化);若想将上述电解后的溶液恢复为与电解前的溶液相同,可以加入一定质量的__________(填序号);
a.Cu b.CuO c.Cu(OH)2 d.CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
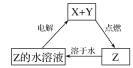
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_______________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
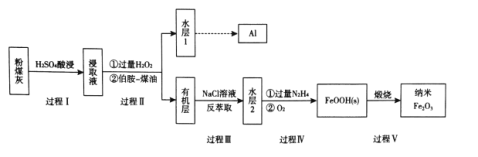
已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-
[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____。
(2)过程II加入过量H2O2的作用是 ___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
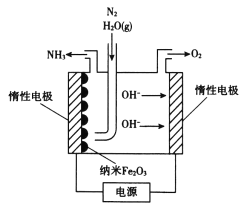
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____,
第二步:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____。
CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和___(填化学式),由此可以推知CN22-的空间构型为___。
(2)尿素分子中C原子采取____杂化。尿素分子的结构简式是____。
(3)三聚氰胺 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
(4)H2与O2发生反应的过程用模型图示如下(“—”表示化学键):

其中过程Ⅰ是___过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的_______分子(填“极性”或“非极性”)。
(5)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_____。

已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离_____(列出计算式)CaO晶体和NaCl晶体的晶格能分别为:CaO3401kJ·mol-1、NaCl786kJ·mol-1。导致两者晶格能差异的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为44%,则氢元素的质量分数为( )
A. 48%B. 8%C. 56%D. 10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com