
下表是几种氯化物的熔点和沸点:
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 熔点/℃ | 801 | 714 | 190(5×101 kPa) | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
据表中所列数据判断下列叙述与表中相吻合的是( )
A.AlCl3在加热条件下不能升华
B.SiCl4晶体属于原子晶体
C.AlCl3晶体是典型的离子晶体
D.SiCl4在晶体中有分子存在
科目:高中化学 来源: 题型:
下列物质的熔、沸点高低顺序中,正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.Al<Mg<Na<K
C.MgO>H2O>O2>N2
D.金刚石>生铁>纯铁>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是( )

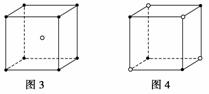
A.图1和图3 B.图2和图3
C.图1和图4 D.只有图1
查看答案和解析>>
科目:高中化学 来源: 题型:
一种金属晶体与一种离子晶体相比较,正确的是( )
A.金属晶体一定比离子晶体微粒堆积得更密集
B.金属晶体一定比离子晶体硬度大
C.金属晶体固态时一定能导电,但离子晶体不能
D.金属晶体一定比离子晶体熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiC NaCl CCl4 CF4
B.SiC NaCl CF4 CCl4
C.NaCl SiC CCl4 CF4
D.CF4 CCl4 NaCl SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属的叙述中,不正确的是( )
A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性
D.构成金属的自由电子在整个金属内部的三维空间中做自由运动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于金属导电性随温度变化的解释,正确的是( )
A.温度增加,自由电子的动能增大,导致金属导电性增强
B.温度增加,阳离子的动能变大,阻碍电子的运动,导致金属导电性减弱
C.温度增加,自由电子的互相碰撞的次数增加,导致金属导电性减弱
D.温度增加,阳离子的动能变大,自由电子与阳离子的吸引力变小,导致金属导电性增大
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
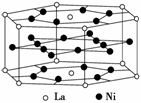
A.LaNi5 B.LaNi
C.La14Ni24 D.La7Ni12
查看答案和解析>>
科目:高中化学 来源: 题型:
用价电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com