
| A. | 糖类、油脂、蛋白质中都只含C、H、O三种元素 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉、纤维素分子组成都可表示为(C6H10O5)n,二者互为同分异构体 |
分析 A.蛋白质中有C、H、O、N等元素;
B.糖类分为单糖、二糖、多糖,单糖不能水解;
C.油脂是高级脂肪酸与甘油形成的酯;
D.淀粉和纤维素可表示为(C6H10O5)n,聚合度n不同;
解答 解:A.糖类、油脂中都只含C、H、O三种元素,蛋白质除此之外还含有N等元素,故A错误;
B.糖类中的单糖不能水解,油脂能水解生成高级脂肪酸和甘油,蛋白质能水解生成氨基酸,故B错误;
C.油脂的主要成分是高级脂肪酸甘油酯,故C正确;
D.淀粉和纤维素可表示为(C6H10O5)n,聚合度n不同,分子式不同,二者不是同分异构体,故D错误;
故选C.
点评 本题考查糖类、油脂、蛋白质的组成、结构与性质,难度不大,注意糖类中的单糖不能发生水解,B为易错点.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:实验题

| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
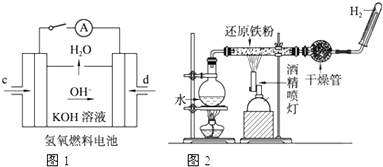
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ②④⑥ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
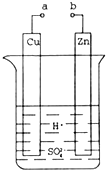 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液:Na+、Ba2+、AlO2-、Cl- | |
| B. | 由水电离得到的c(H+)=1×10-12的溶液中:K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:$NH_4^+$、Al3+、$NO_3^-$、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com