
| A.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后呈红色 |
| B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| C.用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| D.欲配制质量分数为10%的ZnSO4溶液,应将10 g ZnSO4·7H2O 溶解在90 g水中 |
科目:高中化学 来源:不详 题型:填空题
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
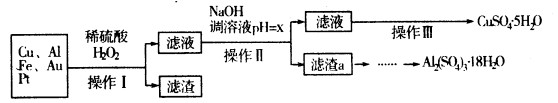
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
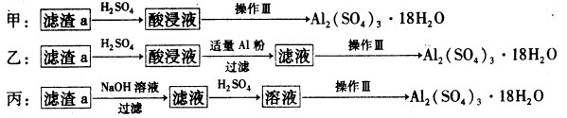
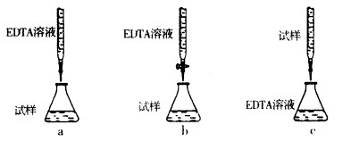
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
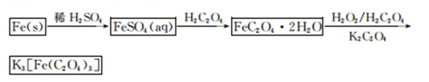
 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用Ba(NO3)2溶液鉴别Na2SO3和Na2SO4 |
| B.除去苯中少量苯酚,向混合物中加入足量的NaOH溶液后过滤 |
| C.将碘水和CCl4倒入分液漏斗,振荡后静置,可将碘萃取到CCl4中 |
| D.取0.1 mol FeCl3溶于蒸馏水,用100 mL容量瓶定容后得到1 mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称取11.70 g食盐 |
| B.用量筒量取12.36 mL盐酸 |
| C.用酸式滴定管量取21.20 mL 0.10 mol/L的H2SO4溶液 |
| D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.给容量瓶检漏时,向容量瓶中注入适量水,左手托住瓶底右手食指顶住瓶塞,倒置数次,观察是否漏水 |
| B.具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C.中和滴定用的锥形瓶中含有少量水,不影响测定结果 |
| D.配制稀硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
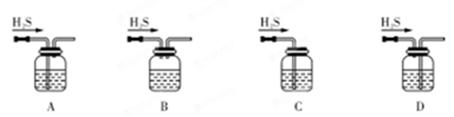
A.用NH4Cl、Ca(OH)2制备NH3时,可用如图所示装置吸收尾气 |
| B.制备Fe(OH)2时,吸有NaOH溶液的胶头滴管要插入亚铁盐溶液中再挤出NaOH溶液 |
| C.加热试管中的固体时,试管口应略向下倾斜 |
| D.用氢气还原氧化铜时,先通一会氢气,再加热氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com