
分析 抗生素具有杀灭细菌的作用;蔬菜、水果中含有大量维生素C;葡萄糖能够直接进入血液,补充能量;食醋既可作为酸性调味剂,又可作为防腐剂;乙烯具有催熟效果;碳酸氢钠能够治疗胃酸;菠萝汁中常用作食品着色剂为柠檬黄;碘酒常用作消毒药物,据此进行解答.
解答 解:E.青霉素能够杀灭细菌,属于抗生素;
C.苹果汁中富含维生素C;
可直接进入血液,补充能量的是单糖D.葡萄糖;
既可作为酸性调味剂,又可作为防腐剂的是B.食醋;
用熟苹果催熟青香蕉利用的是熟苹果释放的A.乙烯;
G.碳酸氢钠能够中和盐酸,可常用作治疗胃酸过多的抗酸剂;
柠檬黄、胭脂红、胡萝卜素等是常用的着色剂,菠萝汁中常用作食品着色剂的是F.柠檬黄;
常用于消毒的药物是H.碘酒,
故答案为:E;C;D;B;A;G;F;H.
点评 本题考查常见的食品添加剂的组成、性质和作用,题目难度不大,主要考查化学元素与人体健康的关系,掌握人体内元素的分类、生理功能、食物来源、缺乏症、摄入时的注意事项等为关键.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:解答题
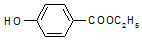 ,生产过程如图:
,生产过程如图: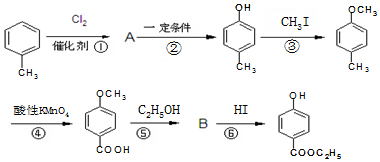
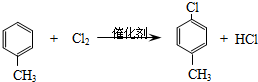 .
. ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | 丙烷分子的比例模型: | ||
| C. | 1,3-丁二烯的分子式:C4H8 | D. | 甲酸甲酯的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NO2 | C. | PM2.5 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
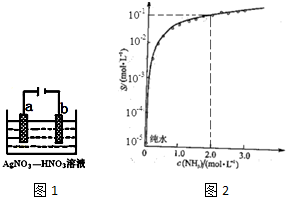
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | c(CO) | c(H2O)(g) | c(CO2) | c(H2) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com