
| 酸性氧化物 | 酸 | 盐 | 混合物 | 电解质 | |
| A | 干冰 | CH3COOH | 烧碱 | (NH4)2SO4•FeSO4•6H2O | C2H5OH |
| B | Al2O3 | HNO3 | NaHSO4 | 氯水 | Cu |
| C | P2O5 | HClO | 纯碱 | 铝土矿 | H2O |
| D | NO | Fe(OH)3 | CaCO3 | 浓盐酸 | NH3 |
| A. | A | B. | B | C. | C | D. | D |
分析 酸性氧化物是指能和碱反应生成盐和水的氧化物;电离出的阳离子全部是氢离子的化合物称为酸;电离出的阴离子全部是氢氧根离子的化合物属于碱;不同分子构成的物质属于混合物,在水溶液或是熔融状态下能导电的化合物属于电解质.
解答 解:A、烧碱属于碱,(NH4)2SO4•FeSO4•6H2O属于纯净物,C2H5OH属于非电解质,故A错误;
B、Al2O3属于两性氧化物,Cu不是电解质,故B错误;
C、选项中的各物质符合自己所属的类别,P2O5能和碱反应生成盐和水,属于酸性氧化物,HClO属于酸,纯碱碳酸钠属于盐,铝土矿是多种氧化物的混合物,水属于电解质,故C正确;
D、NO属于不成盐氧化物,Fe(OH)3属于碱,NH3属于非电解质,故D错误.
故选C.
点评 本题考查氧化物、酸、盐、混合物、电解质的判别,了解常见物质的组成与构成、抓住各概念的特征进行分析判断是解答此类题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
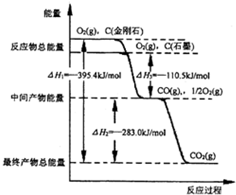 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、CO32-、Cl- | B. | Na+、Ba2+、HCO3-、OH- | ||
| C. | Mg2+、H+、Cl-、SO42- | D. | K+、SO42-、Cu2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
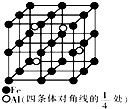 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: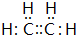
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com